工业生产中物质的循环利用有多种,例如:
下列表示不正确的是
| A.图Ⅰ可表示合成氨,其中N2、H2被循环使用 |
| B.图Ⅱ可表示电解熔融的MgCl2得到镁,其中HCl循环使用 |
| C.图Ⅲ可表示氨催化氧化法制硝酸,其中NO循环使用 |
| D.图Ⅰ可用于侯氏制纯碱CO2的循环利用 |
将19.2 g的铜屑投入到400 mL浓度均为0.5mol/L HNO3和H2SO4的混合溶液中,溶液增加的质量为
| A.4.5 g | B.9.9 g | C.13.2 g | D.14.7 g |
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用 +NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
饱和食盐水溶液
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| |
现象 |
解释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
SO2能使酸性高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| D |
铁与稀硝酸反应有气泡产生 |
铁与稀硝酸发生了置换反应 |
下表各组物质之间通过一步反应就能实现如所示转化的是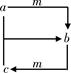
| 物质选项 |
a |
b |
c |
m |
| A |
N2 |
NO |
HNO3 |
O2 |
| B |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
| C |
Na2CO3 |
NaHCO3 |
NaOH |
CO2 |
| D |
CH3CH2OH |
CH3CHO |
CH3COOH |
O2 |
向13.6 g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250 mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入0.5 mol/L的NaOH溶液1.0 L,生成沉淀质量为19.6 g,此时溶液呈中性且金属离子已完全沉淀。下列有关说法正确的是
| A.原固体混合物中Cu与Cu2O的物质的量之比为1:1 |
| B.原稀硝酸中HNO3的物质的量浓度为1.3 mol/L |
| C.产生的NO的体积为2.24 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.1 mol |
一定是的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
| A.13.5L | B.9.0L | C.16.8L | D.15.7L |
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
某无色混合气体中可能含有Cl2、O2、HCl、SO2、NO2、NO、NH3中的两种或多种。将此无色混合气体通过品红溶液后,品红溶液褪色;把剩余气体排入空气中,气体很快变为红棕色,该无色混合气体遇浓盐酸未看到明显现象。下列关于原混合气体成分的判断正确的是
| A.一定有SO2、NH3和NO | B.一定有NO和HCl |
| C.可能有Cl2和O2 | D.一定没有Cl2、NO2、NH3和O2 |
将过量铁粉放入100mL3mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为
| A.2.8g | B.6.3g | C.5.6g | D.11.2g |
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是 
| A.NO2是该过程的最终产物 |
| B.NO和O2必须在催化剂表面才能反应 |
| C.汽车尾气的主要污染成分是CO2和NO |
D.该催化转化的总反应方程式为:2NO +O2 +4CO 4CO2+N2 4CO2+N2 |
往100mL pH=0的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
| A.0.02mol | B.0.08mol | C.0.10mol | D.0.16mol |
将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL氧气。原混合气体中O2的体积可能是(假设氨全部被氧化;体体积均已换算成标准状况)( ) 已知:NO在O2存在时与水可按4NO+3O2+2H2O=4HNO3反应进行
A.23l.5mL, B.268.8mL C.287.5mL D,313.6mL