(13分)雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某兴趣小组收集了该地区的雾霾,试样溶液经必要的预处理后,设计并完成了如下的实验:

已知:NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,根据以上的实验操作与现象,回答下列问题:
(1)气体l的成分可能是 ,进一步确定该气体成分的方法是 ,
实验室制备该气体的方程式为 。
(2)写出沉淀2产生气体的离子方程式 。
(3)经过以上实验可知,该地区雾霾中一定存在的离子有 。
(4)某同学采用了另外一种实验方法,取少量的试样直接加入硝酸银溶液产生白色沉淀,该同学由此就确定一定含有Cl-,你认为他的说法是否合理 (填是或否),其理由是 。
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
| |
溶液中检测出的溶质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2CO3、NaCl |
| 第三次 |
KCl、K2CO3、Na2SO4、NaCl |
(1)三次检测结果中,第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 |
实验操作 |
实验目的 |
反应的离子方程式 |
| 第一步 |
向溶液中滴加过量的硝酸 |
检验 ① 的存在 |
② |
| 第二步 |
继续滴加过量的 ③ 溶液 |
检验SO42-的存在 |
④ |
| 第三步 |
过滤,再向滤液中滴加 ⑤ 溶液 |
检验 ⑥ 的存在 |
Ag++Cl- = AgCl↓ |
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象写出下列物质化学式:A B C D E
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;将沉淀过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
回答下列问题:
(1)原溶液中一定不存在 。
(2)根据实验和必要的计算确定溶液中一定存在的离子有哪些 (写出必要的推理及计算过程)。
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol。
| 阴离子 |
SO42-、NO3-、Cl- |
| 阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显现象;
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变;
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题:
(1)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象是________________;实验中中所发生反应的离子方程式是_________________________;
(2)原溶液中所含阳离子是(写离子符号)___________________.
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是________________g。
某混合物,可能含有以下几种离子:K+、Cl-、 、Mg2+、
、Mg2+、 、Ba2+、
、Ba2+、 ,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 |
物质的量浓度(mol/L) |
| |
|
| |
|
(3)试确定K+是否存在?________,如果存在物质的量浓度为_______,如果不存在理由是 。
有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 |
结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 |
N中不含 离子 |
| ② |
确定M溶液中含有Na+,不含K+ |
 ③用pH试纸检测M溶液,pH试纸呈蓝色 ③用pH试纸检测M溶液,pH试纸呈蓝色 |
|
(2)根据①、②、③中的实验回答:
NO3-存在于________溶液中,理由是____________________________________;
Cl-存在于________溶液中,是根据_________________ 确定的。
(3)根据(1)中的实验确定,M溶液中含有的离子为________________________。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定
不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由 。
有一透明溶液,已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、
HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混和气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(1)淡黄色粉末的名称为 ;
(2)溶液中肯定有 离子,肯定没有 离子,可能有________离子;
(3)写出下列反应方程式
①淡黄色粉末与水反应 ;
②产生刺激性气味气体的离子方程式 ;
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失,反应的离子方程式为 ;
(4)溶液中阳离子的物质的量之比为(H+及没有确定的离子除外) 。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种离子组成,取溶液进行右图实验:
中的若干种离子组成,取溶液进行右图实验:
(1)白色沉淀甲是 。
(2)X溶液中一定存在的离子是 。
(3)白色沉淀乙中一定有: ,可能有 。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式 。
某强酸性溶液X含有Ba 2+ 、Al 3+ 、NH4+、Fe 2+ 、Fe 3+ 、CO32-、SO32-、SO42-、Cl-、
NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
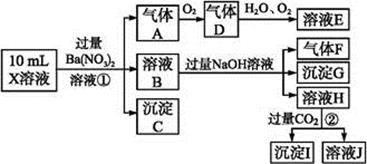
根据以上信息,回答下列问题:
(1)溶液X中除H + 外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H + )="0.04" mol,而沉淀C物质的量0.07 mol,能说明(1)中不能确定的阴离子存在的理由是 。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、 、
、 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B. C.CH3COO- D.
C.CH3COO- D.
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________。
某溶液含有K+、Cu2+、Fe3+、Al3+、Fe2+、Cl—、CO2—3、OH—、NO—3、SO2—4中的几种,已知该溶液中各离子物质的量浓度均为0.2mol/L(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
I.取少量溶液,加入KSCN溶液时无明显变化:
Ⅱ.取原溶液加入BaCl2溶液,有白色沉淀生成;
Ⅲ.另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类没有增加。
请推断:
(l)仅由操作I及现象可得出的结论是____。
(2)仅由操作Ⅱ及现象可得出的结论是____。
(3)由操作Ⅲ及现象可得出溶液中一定含有的阳离子是____(写离子符号)。操作Ⅲ中发生反应的化学方程式为____。
(4)结合三步操作及题干已知,你认为原溶液中所含离子种类共有____种。
(5)另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g,写出此过程中涉及氧化还原反应的化学方程式____。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1。
由②可知存在的离子为 ,浓度是 mol·L-1。
由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
(12 分)某课外活动小组通过实验探究某溶液的溶质可能由下列一种或几种离子构成:
Ba2+、Na+、Fe3+、Cu2+、CO32-、AlO2-、SO32-、SO42-。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 ;
(2)该溶液中肯定存在的离子有_________。可能含有________。怎么用化学方法检验该离子的存在____________________________。(写出操作方法、现象、结论)
(3)向溶液甲中加入NH4HCO3溶液至过量,该过程中发生的离子方程式为:
、 。