某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3―六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 。
(2)乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属 (填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—离子中的几种。为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰。下列推断正确的是
| A.肯定有Na+、Al3+、Mg2+、SO42— | B.肯定有Na+、Mg2+、Al3+、Cl— |
| C.肯定没有K+、HCO3—、MnO4— | D.肯定没有K+、NH4+、Cl— |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
试回答下列问题
(1)由实验②可知溶液中含有的离子为 ,在100mL溶液中该离子的物质的量浓度为
(2)由实验③可以判断中溶液中含有的离子为
(3)由上述实验信息判断下列说法中正确的是
| A.K+一定存在 | B.100mL溶液中含0.01mol CO32- |
| C.Cl-可能存在 | D.Ba2+一定不存在,Mg2+可能存在 |
某澄清溶液中,可能含有NH4+、Mg2+、Na+、Fe2+、Ag+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
(1)用pH试纸检验时,试纸呈深红色。
(2)取溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫色。
(3)向(2)所得水溶液中加入AgNO3溶液,有白色沉淀生成。
(4)另取原溶液,调节pH使其呈中性后,滴加NaOH溶液,开始得白色沉淀;接着加入过量NaOH溶液,过滤后给滤液加热,有刺激性气味的气体产生。
(一)由此判断原溶液中一定有大量的 离子。
(二)判断有无I-所应用的反应的离子方程式是
(三)判断有无Mg2+所应用的反应的离子方程式是
(四)在不能确定的离子中,如何检验其中的阳离子?写出试验名称及判断依据的现象。
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH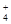 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1、V2、 V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5mol |
2mol |
| n(Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向试管①中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色所需的时间;向试管②中加入0.2mol/L H2C2O4溶液2mL,记录溶液褪色时间,(1)实验表明 褪色更快些。
(2)写出反应的化学方程式 。
(3)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- ⑥C2O42-、Br-、K+、Cl-
Ⅰ.某无色溶液X,由K+、 、Ba2+、Al3+、Fe3+、
、Ba2+、Al3+、Fe3+、 、
、 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
(1)白色沉淀甲是 。
(2)试写出实验过程中生成气体A、B的离子方程式 、 。
(3)通过上述实验,可确定X溶液中一定存在的离子是 ,要确定可能存在的离子,需补加的实验是 。
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电 解时间t的关系图如上。据此回答下列问题:
解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 ;
(3)写出乙烧杯的电解池反应 。
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
已知A、B、C、D分别是Na2SO3、HCl、BaCl2、AgNO3四种物质的水溶液中的某一种,将它们两两混合反应的情况如下:
注:↓表示生成沉淀,↑表示生成气体,/表示不反应。
| |
A |
B |
C |
D |
| A |
|
↓ |
↓ |
∕ |
| B |
↓ |
|
↓ |
↑ |
| C |
↓ |
↓ |
|
↓ |
| D |
∕ |
↑ |
↓ |
|



 ①写出A、B、C、D的化学式A B C D
①写出A、B、C、D的化学式A B C D  ②写出A与C反应的离子方程式
②写出A与C反应的离子方程式 写出B与D反应的离子方程式
写出B与D反应的离子方程式
铁及其化合物在日常生活、生产中应用广泛。
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为________(填字母)。
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: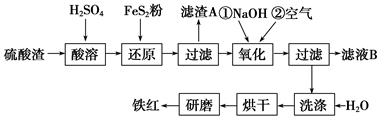
①酸溶过程中Fe2O3发生反应的离子方程式为_____________;“滤渣A”主要成分的化学式为_______________。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式: FeS2+____Fe3++______===______Fe2++____SO42-+______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________________。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
如果pH过大,可能引起的后果是____________________(几种离子沉淀的pH见上表)。
⑤滤液B可以回收的物质有________(填序号)。
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4