某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
(a)取适量溶液,加入过量盐酸,有气体生成,并得到无色透明溶液;
(b)向(a)所得溶液中加入过量碳酸氢铵溶液,有气体生成,且析出白色沉淀甲;
(c)向(b)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是____________________。
(2)溶液中一定存在的离子是____________________。
(3)判断沉淀乙成分的方法是______________________________。
某溶液中可能含有SO42―、CO32―和NO3―,为了检验其中是否含有SO42―,正确的操作方法是取少量溶液置于试管中为排除干扰应先加:
再加
可能发生的离子反应方程式是:
一瓶溶液里可能含有OH—,Cl—,NO3—,CO32—,SO42—,五种阴离子中的某几种,现分别取溶液少许分装于两支试管里,做以下实验,并观察到相应现象如下:
(1)向第一支试管里滴入酚酞试液,溶液变红色。
(2)第二支试管里加入少量Ba(NO3)2溶液,产生白色沉淀,过滤后并将滤液移入第三支试管,向沉淀中加入稀硝酸,无变化。
(3)向第三支试管中加入足量的稀硝酸,再滴加少量AgNO3溶液,产生白色沉淀。
根据上述现象,判断溶液中肯定含有__________________离子,不含_________________离子,无法确定是否存在的离子为_______________________。
某溶液中含有SO42-、CO32-、Cl-三种阴离子。如果每次只检验一种离子,要↑
(1)先检验 ,加入 试剂(或溶液),反应的离子方程式为 ;
(2)然后检验 ,加入 试剂(或溶液),反应的离子方程式为 ;
(3)最后检验 ,加入 试剂(或溶液),反应的离子方程式为 。
甲溶液可能含有 、
、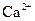 、
、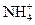 、
、 、
、 、
、 、
、 、
、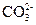 八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的 浓溶液并加热,产生的气体在标准状况下体积为4.48L。
浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6mol/L的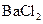 溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1mol/L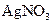 溶液650mL,恰好可完全反应。据此,请回答下列问题(用相应的离子符号表示):
溶液650mL,恰好可完全反应。据此,请回答下列问题(用相应的离子符号表示):
(1)上述实验③中得到沉淀X的质量为__________________;生成沉淀X的离子方程式为_____________________________________。
(2)甲溶液中一定不存在的离子是______________;可能存在的离子是____________。
(3)甲溶液一定存在的离子中,物质的量最大的离子是___________;物质的量最小的离子是_____________,此物质的量最小的离子其物质的量为____________。
某溶液A中可能含有NH4+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、SO42-中的几种离子,且溶液中各离子的物质的量浓度均为0.1mol.L-1。现取该溶液进行如下实验:

(1)溶液A中一定不存在的离子为 (填离子符号)。
(2)溶液A中加入(NH4)2CO3,生成白色沉淀甲和气体甲的原因是 。
(3)白色沉淀乙的成分为 (填化学式)。
(4)为了进一步确定溶液A中是否含有NH4+,另取10ml该溶液,向其中滴加NaOH溶液,沉淀的物质的量随NaOH溶液体积的变化如图所示。

据图回答:
①溶液A中 (填“含有”或“不含有”)NH4+
②所加NaOH溶液的物质的量浓度为 mol.L-1
③若在A溶液中改加10ml0.2mol.L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol
30、从H+、Cu2+、Na+、Ag+ 、NO3- 、SO42-、Cl- 七种离子中恰当地组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是
。
(2)以碳棒为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是
。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水质量都减少,电解后生成碱和氢气,则电解质为 。
(4)以碳棒为阳极,铁棒为阴极,使电解质和水质量都减少,电解后生成酸和氧气,,则电解质为 。
对一份稀溶液作初步分析后发现,溶液无色澄清可能含有SO42-、Na+、CO32-、H+、NO3-、HCO3-、Cl-等离子中的若干种。后又作了如下分析,以确定这些离子是否大量存在。
①用pH试纸测溶液pH,测得溶液pH=1;
②取2ml溶液用BaCl2溶液和稀HNO3进行检验,结果生成了白色沉淀;
③对②中所得的混合物充分静置后,取其澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)在上述实验操作中,有错误的步骤是(填写代号) ,对该错误改正的方法是(要作较详细的说明) 。
(3)到目前为止,不能确定溶液中是否存在的离子是 。
某溶液有Cl-、CO32-、SO42-等,今要求在一次样液中先后检验出这三种离子,请完成下列实验设计:先加足量__________溶液,生成气泡,确定CO32-存在;再加足量__________溶液,现象是_________,确定SO42-存在;过滤后加__________溶液,现象是生成白色沉淀,确定Cl-存在。
胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;(4)
遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有
引起溃疡穿孔的危险。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;(2)凝胶本身覆盖于溃
疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液。
(1)请你推测,甲中含有的主要化学成分是 ;乙中含有的主要化学成分是 。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式

(3)试写出乙中含有的主要化学成分分别与稀盐酸和氢氧化钠溶液反应的离子方程式
铁、铝是应用最广泛的两种金属。完成下列填空:

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,它们互称为 ,其中58Fe原子中子数与质子数之差为 。
(2)工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁 。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出该反应的化学方程式 ,该反应是 (填“吸”或“放”)热反应。
(4)铁粉中混有少量的铝粉,请设计一种实验方案除去铁粉中的铝粉
(5)向某溶液中投入铝片后有大量的H2放出,溶液中不可能大量存在的离子是 (填序号)
a.Cl- b.H+ c.OH- d.HCO3-
(6)铁与稀硝酸反应的方程式如下:3Fe+8HNO3 →3Fe(NO3)2+2NO↑+4H2O
该反应的氧化剂是 ,氧化产物是 ,每转移1.8mol电子,生成NO L(标准状况)。
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42— HCO3— NO3— OH— |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
溶液中有下列阴离子的一种或几种:SO42-、SO32-、CO32-、Cl-
(1)当溶液中有大量的H+时,则溶液中不可能有___________________
(2)当溶液中有大量的Ba2+时,则溶液中不可能有___________________
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是___________________,且各离子的物质的量之比为___________________;肯定不含的阳离子是____________________。写出平行线段线所发生反应的离子方程式: 