已知:I2+2S2O32—=S4O62—+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量分数为________。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=________。(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
T1 |
T2 |
| 水的离子积常数 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<T1<T2,则a__________1×10-14 (填“>”、“<”或“=”),做此判断的理由是______________________________________。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是____________________________。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-a mol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________。
已知:A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,B、C、D三种元素的最高价氧化物对应的水化物分别为X、Y、Z,X、Y、Z可两两相互反应生成盐和水,试推断并用相应的化学用语回答下列问题。
(1)D元素原子的结构示意图为______________________;
(2)X与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
____________________________________;
(3)A、B、C三种元素的原子半径由小到大的顺序为_________________;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈________(填“酸”“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为________。
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
| 化合物 |
甲 |
乙 |
丙 |
| 各元素原子 个数比 |
N(A):N(C) =2:1 |
N(A):N(C) =1:1 |
N(B):N(A) =1:4 |
| 化合物 |
丁 |
戊 |
己 |
| 各元素原子 个数比 |
N(D):N(B):N(C) =2:1:3 |
N(E):N(F) =1:3 |
N(B):N(F) =1:4 |
请完成下列问题:
(1)D的离子结构示意图为________,己的空间构型是________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为________ mol。
(3)8 g丙完全燃烧,生成液态水和CO2,放出445 kJ的热量,则丙燃烧的热化学方程式为________。
(4)F的单质与甲反应的离子方程式为________。
(5)将丁与戊两种水溶液混合,发生反应的离子方程式为________。
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:________。
(2)Cm-和E(m-1)-的还原性强弱为________>________,能证明其还原性强弱的离子方程式为________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为________。
(5)在B、C、E单质中,符合下列转化关系的是________。
单质 化合物一
化合物一 化合物二
化合物二 最高价氧化物
最高价氧化物
对应的水化物
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题: (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
Na2SO4 |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。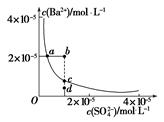
A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:
① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是 。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是 (用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是 ,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb= 。
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度 b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)n(HSO3-)变化关系如下表:
| n(SO32-)n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
(1)由上表判断NaHSO3水溶液显 __性,原因是 __。
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是 __。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为21,则滴入盐酸中n(HCl)为 __mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为 __,再加入1.0 mol CO后,重新达到平衡,CO的转化率 __(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数 __(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
有关键能数据如下:(单位:kJ/mol)
| 化学键 |
H—H |
H—O |
C—H |
C—O |
C=O |
| 键能 |
435 |
463 |
413 |
356 |
745 |
写出甲醇气体完全燃烧生成气态水的热化学方程式: __。
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
| 0.01 mol·L-1 电解质溶液 |
HF |
CH3COOH |
HCN |
NH3·H2O |
| 酸中H+或碱 中OH-的浓度/mol·L-1 |
8.00×10-4 |
1.32×10-4 |
1.00×10-4 |
1.33×10-4 |
若要证明A和B哪一种解释正确,可以在生成的Mg(OH)2沉淀中加入一种物质,这种物质的化学式为__________________。
前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等。
(1)有机颗粒物的产生主要是由于不完全燃烧导致的相关热化学方程式如下:
①C(s)+O2(g)=CO2(g) ΔH1=-94kJ·mol-1;
②C8H16(l)+12O2(g)=8CO2(g)+8H2O(l) ΔH2=-1124kJ·mol-1
③C8H16(l)+4O2=8C(g)+8H2O(l)ΔH3= kJ·mol-1
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ;通过质谱仪发现还有多种副反物,其中之一为: ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(3)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(4)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 |
HA的物质的 量浓度(mol·L-1) |
NaOH的物质的 量浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。