下列溶液中,粒子浓度关系不正确的是
| A.在常温下,向0.01mol∙L-1的NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.25℃时,在0.1mol∙L-1的NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| C.浓度均为0.1mol∙L-1的HF溶液和KF溶液等体积混合:c(F-)+c(HF)=0.2mol/L |
| D.均为0.1mol∙L-1的Na2S溶液和NaHS溶液等体积混合:2c(Na+)=3c(HS—)+3c(H2S)+3c(S2-) |
常温下,将体积均为10mL,pH均为11的 NaOH和CH3COONa溶液加水稀释,pH变化如图所示,下列结论正确的是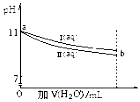
| A.I 和 II 溶液中,离子种类数相同 |
| B.a 点处,I 溶液的浓度为 10-3 mol∙L-1 |
| C.a 点处,I、II 对水的电离平衡影响相同 |
| D.b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多 |
下列实验能达到预期实验目的的是
| 实验 |
实验目的 |
| A.测定等物质的量浓度的CH3COONa和 Na2S溶液pH |
比较CH3COOH和H2S的酸性强弱 |
B. 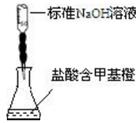 |
测定盐酸的浓度 |
C. 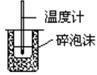 |
测定中和热 |
| D.先用酚酞,后用甲基橙作指示剂,用标准盐酸滴定0.1 mol/L的Na2CO3溶液 |
证明 CO32—水解分两步 |
已知HF酸性比HCN的酸性强。现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中的离子数目为 n1,后者溶液中离子数目为 n2,下列关系正确的是
| A.n1 > n2 | B.n1 = n2 | C.n2 > n1 | D.c(F-) < c(CN-) |
下列有关说法错误的是
| A.室温下的某NaF溶液中,c(H+)=1×10-10 mol∙L-1,说明NaF使水的电离减弱 |
| B.Mg在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 |
| C.纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 |
| D.反应 N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
欲使0.1mol∙L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3¯)都减少,其方法是
| A.通入二氧化碳气体 | B.加水稀释 |
| C.通入氯化氢气体 | D.加入饱和石灰水溶液 |
相同物质的量浓度的NaCN和NaClO溶液相比,前者的pH较大,则下列有关同温、同体积和同浓度的HCN和HClO叙述中,正确的是
| A.酸性:HCN>HClO |
| B.pH:HClO>HCN |
| C.浓度:c(CN-)<c(ClO-) |
| D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
下列溶液均处于 25℃,有关叙述正确的是
| A.AgCl 在同浓度的CaCl2 和NaCl溶液中的溶解度相同 |
| B.0.1 mol∙L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |
下列做法与盐类水解知识无关的是
| A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 |
| B.施肥时,草木灰(有效成分为 K2CO3)不能与碳酸氢铵混合使用 |
| C.Al2S3不能用复分解反应的方法在溶液中制取,而只能用干法制备。 |
| D.配制 FeCl2溶液时常常要在溶液中加入少量铁粉 |
在蒸发皿中加热蒸干并灼烧(低于 300℃)下列物质的溶液,可以得到该固体溶质的是
| A.氯化铝 | B.亚硫酸钠 | C.硫酸镁 | D.碳酸氢钠 |
在盐类的水解过程中,下列各种情况必定发生的是
| A.盐的电离平衡被破坏 | B.水的电离平衡被破坏 |
| C.25℃,溶液的pH不是7 | D.溶液温度升高 |
常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L 盐酸40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。下列说法不正确的是( )
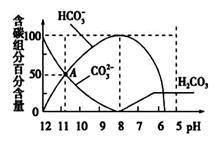
| A.0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B.在A点:c(Na+)> c(CO32-)> c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.当加入20 mL盐酸时,混合溶液的pH约为8 |
常温下,物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.CH3COONH4 |
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O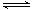 HCOO-+H3O+ HCOO-+H3O+ |
B.HS-+H2O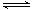 S2-+H3O+ S2-+H3O+ |
C.CO32-+H2O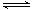 HCO3-+OH- HCO3-+OH- |
D.HCO3-+H2O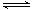 CO32-+H3O+ CO32-+H3O+ |