常温下,下列溶液中微粒的物质的量浓度关系正确的是
| A.将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) |
| B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O) |
| C.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) |
| D.向0.10mol·L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
常温下,下列有关叙述正确的是( )
| A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-6mol•L-1 |
| B.pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ |
| C.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
下列叙述正确的是
| A.25℃时某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1<10c2 |
| C.两种amol/LNaX溶液和bmol/LNaY正盐稀溶液,若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY) |
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |
室温下,下列溶液中粒子浓度大小关系正确的是( )
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)+c(C2O42-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa和CaCl2混合溶液:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| B.将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合, c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| D.25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
常温下,1.0mol/L一元酸HA与等体积等浓度KOH溶液混合,所得溶液粒子的浓度关系如右表(不含水分子的5种粒子,A为短周期元素),下列说法正确的是
| 粒子 |
K+ |
A- |
X |
Y |
Z |
| 浓度(mol/L) |
0.50 |
0.49 |
c(X)>c(Y)>c(Z) |
A.元素A最高价氧化物对应水化物为HAO4
B.表格中X表示HA,Y表示H+
C.所得溶液中c(X)+ c(A-)= c(K+)
D.等体积等浓度的HA和盐酸分别加水稀释10倍后,pH (HA) >pH(HCl)
下列说法正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-)
B.物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(HSO3-)+c(H2SO3)+c(SO32—)]
C.同浓度的下列溶液中,① NH4HSO4 ② NH4Cl ③ NH3·H2O,c(NH4+)由大到小的顺序是:
②>①>③
D.常温下,浓度均为0.1mol/L NaA和HA溶液中pH=8:c(HA)>c(Na+)> c(A—)> c(OH—)> c(H+)
下列叙述错误的是
| A.NaHCO3溶液中:c(H+) +c(H2CO3)=c(CO32-) +c(OH-) |
| B.25℃时,0.2mol·L-1盐酸与等体积0.05 mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D.25℃时,若0.3 mol·L-1 HY溶液与0.3 mol·L-1 NaOH溶液等体积混合后,溶液的pH=9,则: |
c(OH- )-c(HY)=c(H+)=1×10-9 mol·L-1
下列溶液中微粒的物质的量浓度关系正确的是:
| A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH 溶液至中性: c(Na+)>c((SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1mol·L-1NaHCO3溶液: c(Na+)>c(OH-)>c((HCO3-)>c(H+) |
| C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3) |
| D.25℃时,,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
下列比较中,正确的是
A.常温下,同浓度的一元酸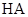 比 比 易电离,则相同浓度的 易电离,则相同浓度的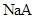 溶液比 溶液比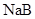 溶液的pH大 溶液的pH大 |
B.0.2 mol/L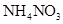 和 0.l mol/L 和 0.l mol/L 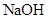 溶液等体积混合后: 溶液等体积混合后: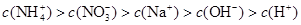 |
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合: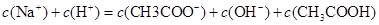 |
D.同浓度的下列溶液:①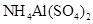 ② ②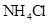 ③ ③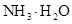 ④ ④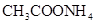 , , |
其中 由大到小的顺序是:①
由大到小的顺序是:①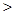 ②
②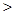 ④
④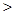 ③
③
下列溶液中离子浓度的关系一定正确的是
| A.pH相同的CH3COONa溶液、NaHCO3溶液、Na2CO3溶液:c(CH3COO-) > c(CO32-) > c(HCO3-) |
| B.pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+) = c(X-) > c(H+) = c(OH-) |
| C.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中:c(K+) = c(H2X) + c(HX-) + c(X2-) |
| D.氨水中加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
室温下,下列溶液中粒子浓度关系不正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.0.1 mol•L-1NaHCO3溶液与0.1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列叙述不正确的是
| A.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其生腐蚀 |
| B.反应SO2(g)+2H2S(g)=3S(S)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
| C.0.1mol·L-1的CH3COOH溶液加水稀释,溶液的pH和溶液中水的电离程度均增大 |
| D.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,存在KW/c(H+)>1.0×10-7 mol·L-1 |
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性;①1×10-3 mol·L-1的氨水b L;②c(OH-)=1×10-3 mol·L-1的氨水c L;③c(OH-)=1×10-3 mol·L-1Ba(OH)2的溶液d L;则a、b、c、d的关系正确的是
| A.b>a=d>c | B.a=b>c>d | C.a=b>d>c | D.c>a=d>b |