常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是
| A.曲线起点处水的电离程度最大,可用pH试纸测定溶液pH |
| B.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- |
| C.氯气~氯水体系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-) |
| D.③点所示溶液中:c(Na+) = c(Cl-)+c(ClO-) |
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |
25℃时,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和20.00 mL 0.100 mol/L醋酸(忽略温度变化)。下列说法正确的是
| A.滴定前,盐酸和醋酸溶液中:c(Cl‾)<c(CH3COO—) |
B.分别加入10.00 mL NaOH溶液时,测得醋酸反应后所得溶液pH=6,则溶液中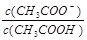 >1 >1 |
| C.当两种溶液的pH均等于7时,两种酸所消耗NaOH溶液体积不相等,醋酸消耗的NaOH溶液体积多 |
| D.加入20.00 mL NaOH溶液时,所得两种溶液中:c(Cl‾)<c(CH3COO—) |
下列有关溶液的说法正确的是
A.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
B.物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中,c( )的大小关系:④>①>②>③
)的大小关系:④>①>②>③
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-)
D.物质的量浓度之比为1∶1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(CO32-)
常温下,向l L pH=l0的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是
| A.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1 |
| B.b点溶液中:c(H+)=1×10-7mol·L-1 |
| C.c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) |
| D.d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
25℃时,0.1 mol·L-1氨水中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
| A.该溶液中氢离子的浓度:c(H+ ) =1×10-11 mol·L-1 |
| B.pH="7" 的NH4Cl和NH3·H2O的混合溶液:c(Cl-) > c(NH4+) > c(H+ ) = c(OH-) |
| C.浓度均为0.1 mol·L-1的NH3·H2O和NH4Cl溶液等体积混合后的碱性溶液中: c(NH4+)> c(Cl-) > c(NH3·H2O) > c(OH-) > c(H+ ) |
| D.0.1 mol·L-1 的氨水与0.05 mol·L-1的 H2SO4溶液等体积混合后所得溶液中: |
2c(NH4+) + 2c(NH3·H2O) = c(SO42-)
将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。
下列说法正确的是
| A.室温时,HA的电离度约为10-6 |
| B.图中B点时,溶液的KW略大于1×10-14 |
| C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-) |
| D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热 |
25℃时,下列各溶液中有关物质的量浓度关系正确的是
A.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH )
C.NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.Na2CO3溶液中:2c(Na+) =c(CO32-)+c(HCO3-) +c(H2CO3) |
| B.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C.向醋酸钠溶液中加入一定量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
常温下,下列各溶液的叙述中正确的是
| A.pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) |
| B.等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3·H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
| C.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(H+)>c(Cl-)>c(CH3COO-) |
现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O②CH3COOH③KHSO4。下列有关离子浓度分析一定不正确的是
A.向①中逐滴加入少量②, 逐渐增大 逐渐增大 |
B.①、③等体积混合后溶液中存在:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) |
| D.①、③按体积比2:1混合:c(NH4+)>c(NH3•H20)>c(SO42-)>c(OH-)>c(H+) |
25 ℃时,浓度均为为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11,下列说法正确的
A.BOH溶于水,其电离方程式是BOH B+ + OH- B+ + OH- |
| B.若将一定量的上述溶液混合后pH = 7,则c(A-)= c(B+) |
| C.在0.1 mol/L BA溶液中,c(B+)> c(A-)> c(OH-)> c(H+) |
| D.若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH = 9 |
常温下,0.1 mol·L-1HX的pH=1,0.1 mol·L-1CH3COOH的pH=2.9。下列说法不正确的是
| A.HX和CH3COOH均可抑制水的电离 |
| B.将HX与CH3COOH 各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol·L-1 |
| C.将等物质的量浓度、等体积的HX与CH3COONa两溶液混合后所得溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+) |
| D.0.3mol·L-1的CH3COOK溶液:c(CH3COO-)+ c(CH3COOH)= c(K+) |
下列溶液中微粒的物质的量浓度关系正确的是
| A.氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
| B.Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3) +c(H+) |
| C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
某二元酸H2A在水溶液中以下列方式进行电离:H2A=H++HA- HA- H++A2-
H++A2-
下列说法正确的是
A.室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度
B.在0.1 mol/L的Na2A溶液中:c(A2-) + c(HA-) + c(H2A) =" 0.1" mol/L
C.在0.1 mol/L的NaHA溶液中,一定有:c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-)
D.向两份等体积NaHA、Na2A的浓度比为1 : 1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图像为:
