江苏省扬州市高三第四次调研测试化学试卷
硫化氢的转化是资源利用和环境保护的重要研究课题。下列关于硫化氢的说法错误的是
| A.H2S是一种弱电解质 |
| B.可用石灰乳吸收H2S气体 |
| C.根据右图可知FeCl3、CuCl2均能氧化H2S |
| D.H2S在空气中燃烧可以生成SO2 |
下列有关化学用语表示正确的是
A.NaOH的电子式: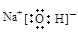 |
B.质子数和中子数均为16的硫原子: |
C.氟原子的结构示意图: |
D.乙醛的结构简式: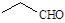 |
25℃时,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Na+、NH4+、SO42-、ClO- |
| B.KW / c(H+) ="0.1" mol·L-1的溶液中:Na+、K+、MnO4-、HCO3- |
| C.0.1 mol·L-1 的Na2SO3溶液中:K+、H+、SO42-、NO3- |
| D.澄清透明的溶液中:Fe3+、Na+、Cl-、 SO42- |
下列有关物质性质与应用对应关系正确的是
| A.炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| B.二氧化硫具有还原性,能用于漂白纸浆 |
| C.碳酸钠能和酸反应,常用于治疗胃酸过多 |
| D.氧化铝熔点很高,用其制造的坩埚可用于熔融烧碱 |
用下列装置进行相应实验,能达到实验目的的是
| A.用装置甲验证浓硫酸的脱水性和强氧化性 |
| B.用装置乙验证浓硝酸的强氧化性 |
| C.用装置丙制备SO2气体 |
| D.用装置丁验证镁片与稀盐酸反应放热 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.0.1 mol·L-1的Na2S溶液中,S2-的数目小于0.1 NA |
| B.0.1 mol丙烷中含有的共价键数目为0.8 NA |
| C.标准状况下,11.2 L甲醇中含有的分子数目为0.5 NA |
| D.0.1 mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3 NA |
下列指定反应的离子方程式正确的是
| A.硅酸钠溶液与醋酸溶液混合:SiO32-+ 2H+ =H2SiO3↓ |
| B.NH4Al(SO4)2溶液与过量稀氨水反应:Al3+ + 3NH3·H2O =Al(OH)3↓ + 3 NH4+ |
| C.用稀硝酸清洗试管内壁的银镜:Ag + 2H+ + NO3-= Ag+ + NO2↑ + H2O |
| D.FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br-+ 2Cl2 =2Fe3+ + Br2 + 4Cl- |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 组别 |
甲 |
乙 |
丙 |
| A |
NO |
NH3 |
H2O |
| B |
CO2 |
Na2CO3 |
Ba(OH)2 |
| C |
Al |
Fe2O3 |
HCl |
| D |
Cl2 |
FeCl2 |
Ca(OH)2 |
短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍。X与Y、Z位于相邻的周期。下列说法正确的是
| A.X的最高价氧化物对应的水化物是弱酸 |
| B.元素Z位于元素周期表的第3周期Ⅵ族 |
| C.Y形成的单质能在二氧化碳中燃烧 |
| D.原子半径的大小顺序: r(Z)>r(Y)>r(X) |
下列关于各图的叙述正确的是
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A)
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH
D.丁表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸溶液得到的滴定曲线
下列有关说法正确的是
| A.为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 |
| B.在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 |
| C.已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 |
| D.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,可知100 mL 0.1 mol·L-1的盐酸与100 mL 0.1 mol·L-1的氨水混合,放出的热量等于0.573 kJ |
某药物中间体X的结构如图所示,下列说法正确的是
| A.该X的分子式为C23H25N2O3 |
| B.每个X分子中含有2个手性碳原子 |
| C.1 mol X最多能与9 mol H2发生加成反应 |
| D.X能发生水解、氧化和消去反应 |
下列关于Fe3+、Fe2+性质实验的说法错误的是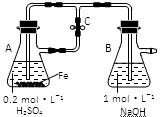
| A.用上图装置可以制备沉淀Fe(OH)2 |
| B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
| C.FeCl3溶液中滴加KSCN溶液会生成红色沉淀 |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
25℃时,0.1 mol·L-1氨水中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
| A.该溶液中氢离子的浓度:c(H+ ) =1×10-11 mol·L-1 |
| B.pH="7" 的NH4Cl和NH3·H2O的混合溶液:c(Cl-) > c(NH4+) > c(H+ ) = c(OH-) |
| C.浓度均为0.1 mol·L-1的NH3·H2O和NH4Cl溶液等体积混合后的碱性溶液中: c(NH4+)> c(Cl-) > c(NH3·H2O) > c(OH-) > c(H+ ) |
| D.0.1 mol·L-1 的氨水与0.05 mol·L-1的 H2SO4溶液等体积混合后所得溶液中: |
2c(NH4+) + 2c(NH3·H2O) = c(SO42-)
一定温度下,向容积为2 L的恒容密闭容器中充入6 mol CO2和8 mol H2,发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH =-49.0kJ·mol-1
测得n(H2)随时间变化如曲线Ⅰ所示。下列说法正确的是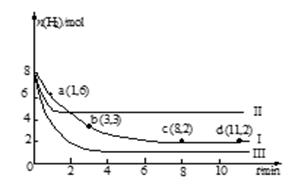
| A.该反应在0~8 min内CO2的平均反应速率是0.375mol·L-1·min-1 |
| B.若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% |
| C.若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 |
| D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
以炼铅厂铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)为原料生产氯化锌的工艺流程如下: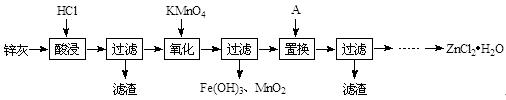
(1)“酸浸”时一般控制温度为30 ℃,温度不宜过高的原因是 。
(2)“氧化”时需控制溶液的pH为5。写出KMnO4氧化Fe2+为Fe3+的离子方程式 。实际生产中高锰酸钾用量远多于理论用量的原因是 。
(3)物质A的化学式是 。
(4)写出流程中省略的操作步骤: ,若操作不当则会产生杂质Zn(OH)Cl,欲降低产品中该杂质的含量,可以采取的方法是 。
化合物G对多种植物病原菌具有抑制作用,由丙酮合成G的路线如下
(1)写出化合物G中含氧官能团的名称 。
(2)反应②的类型为 。
(3)反应①还会得到另一产物H,其分子式为C8H14O2,写出H的结构简式 。
(4)反应⑦生成的G会部分转化为另一产物I,I为链状结构,分子式为C10H18O4,写出I的结构简式: 。
(5)一分子G消去一分子水可得物质J,写出同时满足下列条件的J的一种同分异构体的结构简式: 。
①能与FeCl3溶液发生显色反应;
②分子的核磁共振氢谱有2个峰。
(6)以CH3OH、CH≡CH为原料合成聚丙烯醇 ,写出合成流程图(无机试剂任用)。合成流程图示例如下:
,写出合成流程图(无机试剂任用)。合成流程图示例如下:
聚合氯化铝铁[FeaAlb(OH)cCld]m是一种性能优良的无机高分子絮凝剂,在净水行业得到广泛应用。
(1)在[FeaAlb(OH)cCld]m中d = (用a、b、c表示)。
(2)聚合氯化铝铁净水的性能优于氯化铝和氯化铁的原因可能是 。
(3)为确定聚合氯化铝铁的组成,进行如下实验:
①准确称取5.745 g样品,配成500 mL溶液。取10 mL溶液于锥形瓶中,加适量盐酸,滴加稍过量氯化亚锡溶液。加氯化汞溶液2 mL,充分反应后用0.0100 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗标准溶液10.00 mL。相关反应如下:2FeCl3+SnCl2=2FeCl2+SnCl4;
SnCl2+2HgCl2=SnCl4+Hg2Cl2; 6FeCl2+K2Cr2O7+14HCl=6FeCl3+2CrCl3+2KCl+7H2O
②准确称取5.745 g样品,加入足量的盐酸充分溶解,然后加入足量氨水,过滤、洗涤、灼烧,得固体3.420 g。
根据以上实验数据计算聚合氯化铝铁样品中的n(Fe3+): n(Al3+)。(写出计算过程)
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下: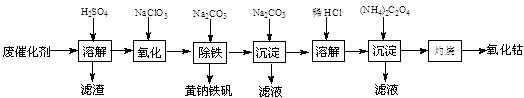
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是 。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式 。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3 Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4 Fe3+ + 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是 。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式 。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是 。
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是 。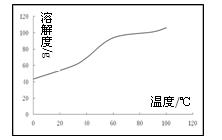
(6)灼烧:准确称取所得CoC2O4 1.470 g,在空气中充分灼烧得0.830 g氧化钴,写出氧化钴的化学式 。
甲醇(CH3OH)是重要的溶剂和替代燃料。
(1)CO和H2的混合气体俗称合成气,可以在一定条件下制备甲醇。
CO(g)+2H2(g) CH3OH(g) ΔH<0,该反应平衡常数的表达式为 。若压强、投料比x[n(CO)/n(H2)]对该反应的影响如图所示,则图中曲线所示的压强关系:p1 p2(填“=”“>”或“<”)。
CH3OH(g) ΔH<0,该反应平衡常数的表达式为 。若压强、投料比x[n(CO)/n(H2)]对该反应的影响如图所示,则图中曲线所示的压强关系:p1 p2(填“=”“>”或“<”)。
(2)NH4Cl(s) = NH3(g) + HCl(g) ΔH =" +163.9" kJ•mol-1
HCl(g) + CH3OH(g) → CH3Cl(g) + H2O(g) ΔH =" -31.9" kJ•mol-1
写出氯化铵和甲醇反应的热化学方程式 ,该反应在一定条件下能自发进行的原因是 。由右图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 L•min-1~30 L• min-1之间。流速过快,会导致氯甲烷产率下降,原因是 。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH→CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是 。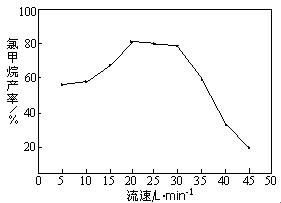
(3)将有机污水去除氧气后加入到如图所示的微生物电解池内,可以实现污水处理和二氧化碳还原制甲醇。写出电解时阴极的电极反应式 。
翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1)Na、Al、Si、O四种元素电负性由大到小的顺序为 。
(2)Cr3+的基态核外电子排布式为 。
(3)Cr可形成配合物K[Cr(C2O4)2(H2O)2],与H2O互为等电子体的一种分子是 (填化学式),草酸根离子(C2O42-)中碳原子的杂化方式为 ,1 mol H2C2O4分子中含有的σ键的数目为 。
(4)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中La3+和Ca2+的物质的量之比为 (x<0.1),三价铬与四价铬的物质的量之比为 。
(x<0.1),三价铬与四价铬的物质的量之比为 。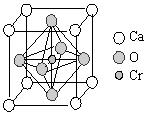
 粤公网安备 44130202000953号
粤公网安备 44130202000953号