已知H2C2O4是二元弱酸,酸式盐NaHC2O4的溶液呈酸性。30℃时,浓度均为0.1mol•L-1 NaHC2O4溶液和Na2C2O4溶液中均存在的关系是
| A.c(H+)•c(OH-) =1×10-14 |
| B.c(H+) + c(H2C2O4) =c(C2O42-)+ c(OH-) |
| C.c(Na+)+ c(H+)= c(OH-)+ c(HC2O4--)+ 2c(C2O42-) |
| D.c(OH-) = c(H+) +c(HC2O4-)+ 2c(H2C2O4) |
下列溶液中微粒的物质的量浓度关系正确的是
| A.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: c(CH3COONa) > c(NaClO) > c (NaHCO3) |
| B.Na2CO3溶液:c(OH-)—c(H+)=c(HCO3-)+ c(H2CO3) |
| C.等浓度的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) |
| D.0.1 mol·L-1的KHA溶液,其pH=10:c(HA-)> c(OH-)> c(H+)> c(A2-) |
缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法错误的是
| A.加入少量强碱,发生反应HPO42—+OH— |
| B.加入少量强酸,发生反应HPO43—+H+ |
| C.c(Na+)+c(H+)=c(OH—)+c(H2PO4—)+2c(HPO42—)+3c(PO43-) |
| D.c(Na+)/2>c(PO43—)+c(HPO42—)+c(H2PO4—)+c(H3PO4)>c(Na+)/3 |
下列解释实验事实的方程式不正确的是()
| A. |
|
| B. |
"
|
| C. |
铁溶于稀硝酸,溶液变黄:
|
| D. |
向
|
下列液体均处于25,有关叙述正确的是()
| A. |
某物质的溶液
|
| B. |
|
| C. |
|
| D. |
|
下列有关溶液的说法中,正确的是
| A.相同物质的量浓度的下列溶液中:①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3·H2O,c(NH4+) 由大到小的顺序是:①>②>③>④ |
B.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na +) + c(H+) = c(S2―) + c(HS―) + c(OH―) +) + c(H+) = c(S2―) + c(HS―) + c(OH―) |
| C.同温时,HF比HCN易电离,则NaF溶液的pH 比NaCN 溶液的pH小 |
| D.常温下,BaSO4(s)在纯水中的溶解度与在稀硫酸溶液中溶解度相同 |
常温下,对下列各溶液的叙述不正确的是( )
A. 溶液中: 溶液中:  |
B.在 的 的 溶液中, 溶液中, |
C. 的盐酸与 的盐酸与 的 的 溶液等体积混合后,溶液中一定有 溶液等体积混合后,溶液中一定有 |
D.向 氨水中加入少量 氨水中加入少量 固体,溶液中 固体,溶液中 增大 增大 |
已知,常温下某浓度NaHSO3稀溶液的pH<7。则该稀溶液中下列粒子关系正确的是
| A.c(Na+)>c(HSO-3)+c(SO2-3) | B.c(Na+)>c(HSO-3)>c(H2SO3)>c(SO2-3) |
| C.c(Na+)+c(H+)=2c(SO2-3) | D.c(Na+)+c(H+)=c(HSO-3)+c(OH-) |
下列溶液中有关微粒浓度的关系不正确的是
A.向0.2 mol/L KA溶液中加入等体积的0.1 mol/L HCl溶液,得pH=10的混合溶液:
c(K+)>c(HA)>c(Cl-)>c(A-)
B.c1 mol/L pH=a的醋酸,c2 mol/L pH=b的醋酸,若a+1=b,则c1 >10 c2
C.浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
D.某二元弱酸的酸式盐NaHA溶液:c(H+)+c(H2A)=c(OH-)+c(A2-)
在等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中,下列式子表达可能不正确的是
A. c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)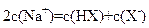 B. c(Na+)+ c(H+)=c(X-)+c(OH-)
B. c(Na+)+ c(H+)=c(X-)+c(OH-)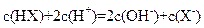 C.
C.
D.
根据表中提供的数据,判断下列说法正确的是
AB电离理论
| A.等浓度的NaCN、NaHCO3、Na2CO3溶液中,pH(Na2CO3)>pH(NaCN)>pH(NaHCO3) |
| B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b |
| C.等浓度的NaCN、NaHCO3混合溶液中c(Na+)+ c(H+) =c(CN-) + c(HCO3-) + c(OH-) |
| D.NaCN溶液中通入少量CO2,发生的反应可表示为:2NaCN + H2O + CO2 =" 2HCN" + Na2CO3 |
下列推断正确的是 ( )
| A.由AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O,可推知氢氧化银氨是强碱 |
| B.SO2气体通入酸性高锰酸钾溶液,溶液紫红色褪去,可推知SO2具有漂白性 |
| C.CaH2和H2O反应生成Ca(OH)2和H2,可推知反应中1mol CaH2失去1mole- |
D.2L 0.1mol/L Na2CO3溶液中 水解,可推知阴离子物质的量总和小于0.2mol 水解,可推知阴离子物质的量总和小于0.2mol |
常温下,向一定浓度的醋酸溶液中逐滴加入氢氧化钠溶液直至过量,在此操作过程中,有关溶液中离子浓度变化的大小关系不正确的是 ( )
| A.当pH=7时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| B.当pH>7时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C.当恰好完全中和时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.反应全程都有关系:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是
A.滴加前盐酸的物质的量浓度为0.1 mol·L-1
B.B点的横坐标a=10
C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-)
D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH