下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
T2 |
| 水的离子积常数 |
1×10-14 |
1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
| 难溶物 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
| Ksp |
8.0×10-16 |
8.0×10-38 |
1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液。这九种物质间反应的转化关系如图所示

(1)写出四种单质的化学式
A________ B_______ C______ D______
(2)写出H+B→G的离子方程式 ;
(3)写出G+I→H+D+E的化学方程式 ;
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.2mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2 =Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 保留到小数点后两位)。
(1)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=____________。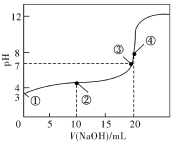
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
0.01mol·L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是___________________。
(3)向0.1mol·L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是____________________。
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加入1mol·L-1的H3PO4,请作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图像。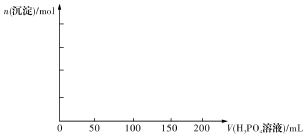
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是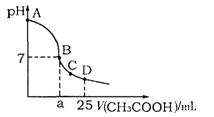
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
下列各表述与示意图一致的是( )
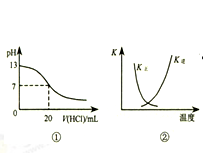
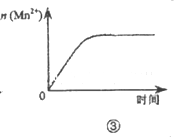
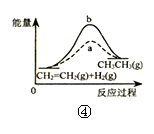
| A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B.图②中曲线表示反应2SO2(g)+O2(g)⇌2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.0l mol•L-1KMnO4酸性溶液与过量的0.1 mol•L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.室温下,水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.相同温度下,等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为②>④>③>① |
| D.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中c(CH3COOH)/c(H+)·c(CH3COO-) 增大 |
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
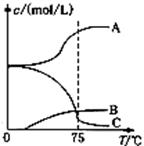
(2)实验室制取氯酸钠可通过如下反应3C12+6NaOH 5NaC1+NaC1O3+3H2O
5NaC1+NaC1O3+3H2O
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是 。
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH)。下列判断正确的是( )
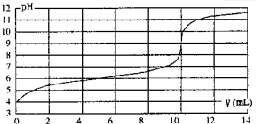
| A.HA的浓度为1×10-4mol•L-1 | B.实验时可选甲基橙作指示剂 |
| C.pH=7时,溶液中c(Na+)>c(A-) | D.V=10mL,酸碱恰好中和 |
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
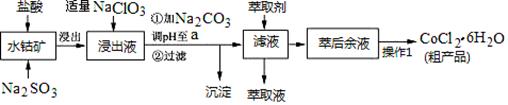
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式____________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH |
| 阴离子 |
CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是______ ____,B是___ ___(填化学式) 。
用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)写出C和D反应的离子方程式__________ _。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____ ____(填微粒浓度符号)=_____ ______(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 _。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(6)现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。在本实验的滴定过程中,下列操作会使实验结果偏大的是__ (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:
2 SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_ __。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为______(用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来滴定氢氧化钠的的浓度,反应如下:KHC8H4O4 + NaOH = KNaC8H4O4 + H2O。若氢氧化钠的溶液浓度为0.1mol·L-1,到达终点时,溶液的pH约为9.1。
(1)为标定氢氧化钠溶液的浓度,应选 用作指示剂,达到滴定终点时溶液由 色变为 色。
(2)在测定氢氧化钠溶液浓度时,有下列操作:
①向溶液中加入1-2滴指示剂
②向锥形瓶中加20-30ml蒸馏水溶解
③用氢氧化钠溶液滴定到终点,半分钟不褪色
④重复以上操作
⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250ml锥形瓶中
⑥根据两次实验数据计算氢氧化钠的物质的量浓度。
以上各步中,正确的(填序号)操作顺序是
(3)上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响?
并说明理由:
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果 (填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH 20 mL,则NaOH溶液的浓度为 (结果保留四位有效数字)。
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有________;实验中应测定的数据有________。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平称取该样品5.000 g,全部溶于水配制成1 000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是___ _____。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL |
0.00 |
12.00 |
18.00 |
22.00 |
23.00 |
23.96 |
24.00 |
24.04 |
25.00 |
26.00 |
30.00 |
| pH |
13.1 |
12.6 |
12.2 |
11.7 |
11.4 |
9.9 |
7.0 |
4.0 |
2.7 |
2.4 |
1.9 |
请在坐标图中绘制出上述中和滴定的曲线。
| |
变色范围(pH) |
颜色 |
|
| 酸 |
碱 |
||
| 甲基橙 |
3.1~4.4 |
红 |
黄 |
| 石蕊 |
5.0~8.0 |
红 |
蓝 |
| 酚酞 |
8.2~10.0 |
无 |
红 |

⑤如上表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
⑥样品中,NaOH的质量百分含量为____________。
(3)以下滴定操作能导致最终滴定结果偏低的是( )
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗
碱式碳酸钴[ Cox(OH)y(CO3)z ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
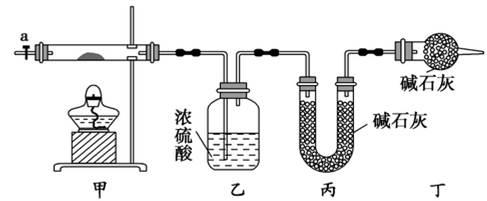
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_____________________
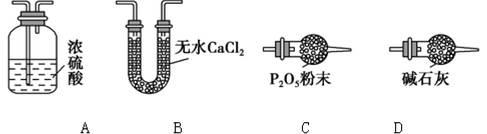
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的______(填字母)连接在_________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:
| |
乙装置的质量/g |
丙装置的质量/g |
| 加热前 |
80.00 |
62.00 |
| 加热后 |
80.36 |
62.88 |
则该碱式碳酸钴的化学式为_________________。
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为___________。
(6)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
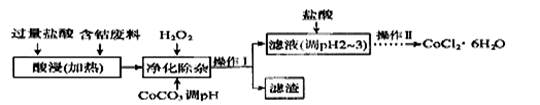
已知:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
CO(OH)2 |
Al(OH)2 |
| 开始沉淀(PH) |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀(PH) |
4.1 |
9.7 |
9.2 |
5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整PH为2~3的目的为__________________________________。
④操作Ⅱ过程为___________(填操作名称)、过滤。
(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
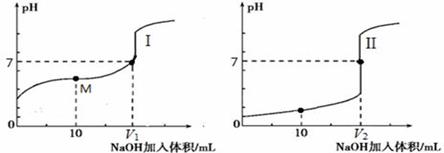
① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 |
溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 |
现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1。(忽略溶液体积变化)