12分)许多尾气中含有NOX、SO2等造成空气污染的气体。根据要求回答下列问题:
(1)已知:NO2(g)+CO (g)  CO2 (g) +NO (g)。
CO2 (g) +NO (g)。
①密闭容器中发生该反应时,c(CO2)随温度(T)变化曲线如图所示。据此判断,升高温度,该反应的平衡常数 (选填“增大”、“减小”“不变”)。
②NO对臭氧层破坏会起催化作用,其主要过程为:Ⅰ.O3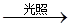 O+O2
O+O2
Ⅱ.NO+O3 →NO2+O2
Ⅲ. 。(请写出“Ⅲ”中的化学反应方程式。)
(2)将CO2和H2合成二甲醚(CH3OCH3)已取得了较大的进展,其化学反应为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式 ;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时负极电极反应式 。
(3)室温条件下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.10mol·L-1的NaOH溶液和氨水,下图是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图。
①该曲线表示滴定 (填“NaOH”或“氨水”)的过程;
②当向20.00mLNaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则v = 。(保留2位小数)
(16分)钢厂酸洗废液(成分如下表所示)在工业生产中还具有很多用途。
(1)欲检验该酸洗废液中含有的少量Fe3+,最宜选用的试剂是_____溶液;为检验其中的Fe2+,某同学设计了如下实验:取该酸洗废液少许加入试管中,滴入几滴酸性KMnO4溶液后发现紫色消失。该同学得出结论:该溶液中含有Fe2+。大家认为该同学的实验设计不合理,理由是____________________________(用必要的文字和离子方程式解释)。
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为______;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在__________(填“阴”或“阳”)极生成高铁酸钾(K2FeO4)。
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如下:
①适当调高滤液A的pH,Al3+和Fe2+转化为沉淀,原因是______________(请用沉淀溶解平衡的理论解释)。
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为________________。
③25℃时,PAFSC的除浊效果随溶液pH的变化如图所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是______(填下列序号字母)。
a.4~5 b.5~7 c.7~8 d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了_____现象。
(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: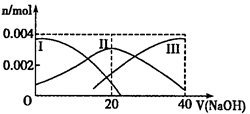
①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题: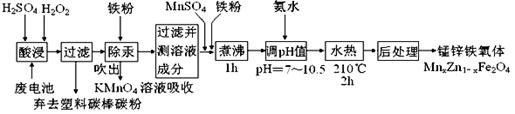
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。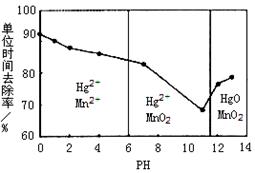
①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
以下是对化学反应变化过程及结果的研究。按要求回答问题:
(1)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应C2H5OH(g)=CH3OCH3(g))△H3=+50.7kJ·mol-1
则乙烯气相直接水合反应
C2H4 (g)+H2O(g)=C2H5OH(g)的△H= 。
(2)在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)用一个离子方程式表示反应:100ml 3mol·L-1NaOH溶液中通入标准状况下4.48LCO2 ;所得溶液中离子浓度大小排列顺序为: ;
(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。下图是该燃料电池示意图,产生的X气体可直接排放到大气中。
a电极电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(8分)KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是__________ __________;
②所配制KMnO4标准溶液的物质的量浓度为_______________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____(填“偏高”或“偏低”)。
(本题共11分)氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
28.常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42— 三种微粒的物质的量浓度大小关系: 。
29.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为 。
30.铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较): 。
31.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4 + KF + H2O2 + HF → K2MnF6 +O2 + H2O
②SbCl5 + HF → SbF5 + HCl
③K2MnF6 + SbF5 → KSbF6 + MnF3 + F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为 ____;反应③中SbF5表现的性质为 ______性。
32.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3—和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4— H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对它们进行研究具有重要意义。请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度(mol/L) |
4×10−6 |
6×10−6 |
2×10−5 |
4×10−5 |
3×10−5 |
2×10−5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(3)消除氮氧化物和硫氧化物有多种方法。
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①由图可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,当 =1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
=1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为 。
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,
理论上可再生 mol Ce4+。
Ⅲ.用活性炭还原法可以处理氮氧化物。如发生反应:
C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ/mol。
N2(g)+CO2(g) △H=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 时间(min) 时间(min)浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①Tl℃时,该反应的平衡常数K= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(答一种即可)。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为_________________。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:_________________。
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_________________。
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢
2H2O 2H2↑+O2↑
2H2↑+O2↑
D天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
从3 min到9 min,v(H2)=_______mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
I.(1)H3PO2是一元中强酸,写出其电离方程式_________________________________。
(2)③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显______(填“酸性”、“中性”或“碱性”)。
II.现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液混合,溶液的pH=___ ___,若两溶液不等体积混合,则
pH___ ___。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)________ V(乙) ( 填“>”、“<”或“=”)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)________ c(CH3COO-) ( 填“>”、“<”或“=”)。
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ ΔH>0。
CH3COO‾+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=_________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__________(保留三位有效数字)。
氨气在工农业生产中有重要应用。
Ⅰ. (1)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____________________。
②FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O=Fe(OH)2↓+2NH和________________________。
(2)已知氨气极易溶于水,而难溶于有机溶剂CCl4。下列装置中不适宜做氨气尾气吸收的是 。

Ⅱ.现代传感信息技术在化学实验中有广泛的应用。

某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入 做指示剂;用0.0500 mol•L-1HCl滴定。终点时溶液颜色由 色变为 色,用pH计采集数据、电脑绘制滴定曲线如下图。

(3)据图,计算氨水的浓度为 mol•L-1;比较当VHCI=17.50ml时溶液中离子浓度大小关系 。
(4)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水导致测定结果偏低 |
| B.酸式滴定管在滴定前有气泡,滴定后气泡消失测得氨水的浓度偏高 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏低 |
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中c(H+)/c(OH-)=___________________。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_______。该温度___________25℃。
(3)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=____________
②若所得混合液的州pH=10,且a=12,b=2,则Va:Vb=____________