在a mL醋酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,滴定曲线如图所示。
(1)醋酸溶液浓度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b点,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在____;
A.2与a之间 B.a与b之间
C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是________。
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HB物质的量浓度(mol/L) |
KOH物质的量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.1 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L________?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HB是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算),c(K+)-c(B-)=_mol/L。
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 ( )。
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
已知:I2+2S2O32—=S4O62—+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量分数为________。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=________。(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
T1 |
T2 |
| 水的离子积常数 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<T1<T2,则a__________1×10-14 (填“>”、“<”或“=”),做此判断的理由是______________________________________。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是____________________________。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-a mol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________。
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小。
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在如图所示元素周期表(局部)中的相应位置上。
(2)X的最高价氧化物对应水化物的稀溶液与铜反应的化学方程式为 。
(3)一定条件下,1 mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为 __。
Ⅱ.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是 __(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250 mol·L-1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。
其中,a点表示两种物质恰好完全反应。
①图中x (填“>”“<”或“=”)7。
②室温时,HR的电离常数Ka= (填数值)。
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 |
HA的物质的 量浓度(mol·L-1) |
NaOH的物质的 量浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH=5的稀醋酸溶液中,c(CH3COO-)= (列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸) V(醋酸),反应的最初速率为:v(盐酸) v(醋酸)(填“>”、“<”或“=”)。
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是 。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为 。
(5)已知:90 ℃时,水的离子积常数为KW=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)= (保留三位有效数字) mol/L。
25 ℃时,电离平衡常数:
| 弱酸的化学式 |
CH3COOH |
HClO |
H2CO3 |
| 电离平衡常数(25 ℃) |
1.8×10-5 |
3.0× |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ; 
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是__________________________________________。(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为_________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO42-)=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是__________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO42-)=________ mol·L-1。
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:常温下将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(1)HA为 酸,HB为 酸(填“强”或“弱”)。
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为 (用酸、碱化学式表示)。
(3)若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为c(A-) (填“大于”、“小于”或“等于”)c(M+)。
(4)若b+c=14,则MOH为 碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH 7(填“大于”、“小于”或“等于”)。
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“="”" );
②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
A、B、C、D分别为NH4HSO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,溶于水均完全电离,现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a________b(填“>”“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(3)C溶液与D溶液反应的离子方程式为__________________________________________
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为________________________________________________________________________。
(5)已知沉淀甲的Ksp=x。将0.03 mol·L-1的A溶液与0.01 mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为________(用含x的代数式表示,混合后溶液体积变化忽略不计)。
二元弱酸是分步电离的,25时碳酸和草酸的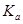 如下表:
如下表:
| H2CO3 |
Ka1=4.3×10-7 |
H2C2O4 |
Ka1=5.6×10-2 |
| Ka2=5.6×10-11 |
Ka2=5.42×10-5 |
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。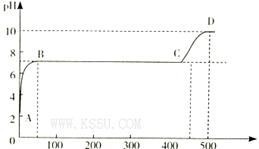
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。