某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,说明HA为__________酸(填“强”、“弱”)向此溶液中加入稀NaOH溶液,使其恰好完全反应,所得溶液pH_________7(填“>”“<”“=”),用离子方程式表示其原因__________.
(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,证明HmA是_______酸(填“强”、“弱”)。若某浓度的NamA溶液pH=9,则该溶液中水电离的c(OH-)=_________mol/L.
(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,若生成的正盐中只有一种离子能水解。则该离子水解的离子方程式为_________________________;若m、n都为1,所得混合液中各离子的物质的量浓度由大到小的顺序是____________。
(4)现有相同浓度的HA1、HA2两种溶液、蒸馏水、常见指示剂(如石蕊、酚酞)、pH试纸以及常用的实验仪器,有两位同学进行试验:一位同学取少量HA1溶液,滴加2滴石蕊试液,试液变红。微热,观察发现溶液红色加深,推断HA1为________ 酸(填“强”、“弱”)。另一位同学取少量HA2溶液,测定其pH。然后将溶液稀释100倍,再测其pH。对比两次测定的pH相差2,据此推断HA2为__________酸(填“强”、“弱”)。
25 ℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10-5 |
K1 4.3×10-7 K2 5.6×10-11 |
3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是______________(填编号);
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.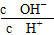
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是__________________________________________,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:____________________________________;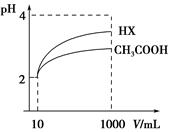
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液 的pH |
| a |
0.1 |
0.1 |
pH=9 |
| b |
c |
0.2 |
pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③ a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 |
电离平衡常数(25℃) |
| NH3·H2O |
Kb=1.77×10-5 |
| HCN |
Ka=4.93×10-10 |
| CH3COOH |
Ka=1.76×10-5 |
| H2CO3 |
Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。
(1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
(1)常温下pH="5" HCl溶液和pH=5的AlCl3溶液中由水电离产生的c (H+) 之比等于 。
(2)写出泡沫灭火器灭火时发生反应的离子方程式 。
(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有 种微粒,各离子浓度从大到小的顺序为 。
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(忽略溶液混合时的体积变化)。
回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”) ② K点对应的溶液中c(M+)+c(MOH)= mol·L-1。
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)K2SO4溶液呈 ____________ (填“弱酸性”、“中性”或“弱碱性”),其理由是_____________________________(用离子方程式表示)。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为________________________________。
(3)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO42-)="0.029" mol·L-1,则HSO4-的电离常数Ka="____________" (保留两位有效数字);0.10 mol·L-1的H2SO4溶液中c(H+)____________ 0.129mol·L-1(填“>”、“=”或“<”)。
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。
(1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。
(2)下列化学方程式可能正确的是 。
A.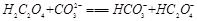 |
B.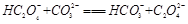 |
C.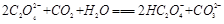 |
D.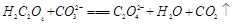 |
(3)常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加0.01 mol·L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为______________________________________________。
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。
③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH4+ |
阴离子 |
CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中 = ;
= ;
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
(1) 25℃时,部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 |
Ki=1.7×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
①HCOONa溶液呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)。
②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是________(填“盐酸”或“HCOOH”),原因是 。
③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”) 。
(2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
①M、N点对应的温度分别是T1、T2,则T1 T2(填“>”、“=”或“<”)。
②T2时,水的离子积常数Kw= ,pH=9的NaOH溶液中,由水电离产生的c(H+)= mol/L。
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “="”" 或“<”)。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 |
电离平衡常数(25℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+) ________
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。