下列说法正确的是
| A.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) |
| C.浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3·H2O)+c(NH4+)=0.1mol/L |
| D.pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.将纯水加热到95°C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加人少量碳酸钠固体,c(H+)减小,Kw不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |
pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是
| A.CH3COOH溶液的浓度为0.1 mol·L-1 |
| B.图中点①到点③所示溶液中,水的电离程度先增大后减小 |
| C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-) |
| D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+) |
下列说法正确的是
| A.室温下用广范pH试纸测得某氯水的pH=4 |
| B.酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 |
| C.若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 |
| D.酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= 。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(1)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250 mL 溶液,
(2)用 0.2000 mol·L-1标准盐酸滴定待测烧碱溶液,实验操作如下
| A.用碱式滴定管取上述烧碱溶液10.00 mL,注入锥形瓶中,加入指示剂。 | B.用待测定 的溶液润洗碱式滴定管。 | C.用蒸馏水洗干净滴定管。 | D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~ 3 cm处,再把酸式滴定管固定好, 调节液面至刻度“0”或“0”刻度以下。E.检查滴定管是否漏水。F.另取锥形瓶,再重复 操作一次。G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度。 |
①滴定操作的正确顺序是(用序号填写):________________
②该滴定操作中应选用的指示剂是:________________
③在G操作中如何确定终点?________________
(3)数据处理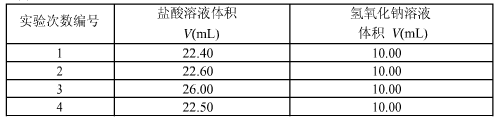
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为__________,烧碱的纯度为_________。
(4)下列操作,会导致实验结果偏低的是________(填序号)。
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗
欲用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,下列有关说法正确的是
| A.滴定管在装溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| B.锥形瓶在装待测溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| C.滴定过程中,两眼注视滴定管装液面的变化 |
| D.装标准液的滴定管中有气泡而滴定前未排出,则滴定结果将偏低 |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
25℃时,水的电离达到平衡:H2O H++OH-;DH>0,则下列叙述正确的是
H++OH-;DH>0,则下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 |
| B.应该选择酚酞作指示剂 |
| C.滴定过程中眼睛应始终注视滴定管内液面变化 |
| D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为( )
| A.2∶11 | B.11∶2 | C.9∶2 | D.2∶9 |