根据表中信息判断,下列选项正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4…… |
| ② |
C12、FeBr2 |
FeC13、FeBr3 |
| ③ |
MnO4-…… |
C12、Mn2+…… |
A.第①组反应的其余产物为H2O、MnSO4
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成lmol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4一>Cl2> Fe3+> Br2
G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G→Q+NaCl ②Q+H2O→X+H2
③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
则G、Q、X、Y、Z这五种化合物中氯元素的化合价由低到高的顺序为
| A.QGZYX | B.GYQZX | C.GYZQX | D.ZXGYQ |
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
| A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
| B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |
| C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 |
| D.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关叙述中,正确的是
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:2ClO-+CO2+H2O===2HClO+CO32—
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3Br2+6CO32-+3H2O=5Br-+ BrO3-+6HCO3-
| A.② ④ | B.① ③ | C.② ③ | D.① ④ |
已知可以发生下列化学反应:
(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br-
由上述反应可以推断氧化剂的氧化性强弱顺序为
| A.Br2>Fe3+>I2 | B.Fe3+>Br2>I2 | C.I2>Br2>Fe3+ | D.Br2>I2>Fe3+ |
已知电离平衡常数:H2CO3>HClO>HCO,下列有关叙述中,正确的是
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:2ClO-+CO2+H2O===2HClO+CO
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O="5" Br-+ BrO3-+6HCO3-
| A.②④ | B.①③ | C.②③ | D.①④ |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
(8分)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验).
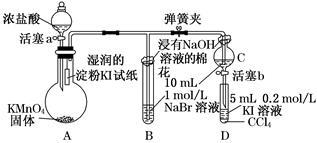
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________.
(2)验证氯气的氧化性强于碘的实验现象是________________.
(3)B中溶液发生反应的离子方程式是__________________________.
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____ ____.
(5)过程Ⅲ实验的目的是___ _ __.
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________,得电子能力逐渐减弱.
(1)下列几种物质:①H2O、②Fe(OH)3胶体、③Mg、④蔗糖、⑤盐酸溶液、⑥Ca(OH)2、属于电解质的是 ,属于分散系的是 ;(用数字序号填空)
(2)含氧原子数相同的SO2和SO3的质量之比是 ,物质的量之比是 。
(3)已知: 2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-,Cl2+2Br-===2Cl-+Br2。 向含有1 mol FeI2和1mol FeBr2的溶液中通入2 mol Cl2,充分反应后,此时被氧化的离子是________;(填写离子符号),如果向上述原溶液中通入3 mol Cl2,充分反应后,此时所得溶液中含有的离子 。(填写离子符号,忽略水的电离)
常温下,发生下列几种反应 :
① 16H ++ 10Z-+ 2XO4-= 2X2++ 5Z2 + 8H2O
② 2A2++ B2 = 2A3++ 2B-
③ 2B-+ Z2 = B2 + 2Z-
根据上述反应,下列结论判断错误的是:( )
| A.溶液中可发生:Z2 + 2A2+ = 2A3+ + 2Z- |
| B.还原性强弱顺序为:A2+> B- > Z- > X2+ |
| C.X2+是XO4-的还原产物 |
| D.Z2在反应①中是还原产物,在反应③中是还原剂 |
根据反应(1)~(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
(1)Cl2+2KI=2KCl+I2
(2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2
(4)H2S+I2=S+2HI
| A.H2S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>H2S |
| C.Fe3+>Cl2>H2S>I2. | D.Cl2>I2>Fe3+>H2S |
根据以下几个反应:
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2KI=2FeCl2+2KCl+I2
④I2+SO2+2H2O=H2SO4+2HI判断还原性由强到弱的顺序是
| A.I->Fe2+>SO2 >Cl- | B.SO2>Fe2+>I-> Cl- |
| C.SO2>I ->Fe2+> Cl- | D.Fe2+>I->Cl->SO2 |
由相同条件下的三个反应:2A +B2 ="2B" +A2;2C +A2 ="2A" +C2;2B +D2 ="2D" +B2;
可判断
| A.氧化性:A2>B2>C2>D2 |
| B.还原性:C->A->B->D- |
| C.2A-+ D2 = 2D-+A2不能进行 |
| D.2C-+B2 =2B-+C2不能进行 |
根据下列反应判断有关物质还原性由强到弱的顺序正确的是
(1)H2SO3 + I2 + H2O =" 2HI" + H2SO4
(2)2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
(3)3FeCl2 + 4HNO3 = 2FeCl3 + NO↑+ 2H2O + Fe(NO3)3
| A.H2SO3>I->Fe2+>NO |
| B.I->H2SO3>Fe2+>NO |
| C.Fe2+>I->H2SO3>NO |
| D.NO>Fe2+>H2SO3>I- |
根据下列三个方程式:I2+SO2+2H2O=H2SO4+2HI; 2FeCl2+Cl2=2FeCl3;
2FeCl3+2HI=2FeCl2+2HCl+I2 有关微粒的还原性强弱顺序是
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2> I- | C.Fe2+>I->SO2>Cl- | D.SO2>I->Fe2+>Cl- |