已知I-、Fe2+、SO2、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->Fe2+>H2O2,则下列反应不能发生的是
| A.2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+ |
| B.I2+SO2+2H2O = H2SO4+2HI |
| C.H2O2+H2SO4 = SO2↑+O2↑+2H2O |
| D.2Fe3++2I-= 2Fe2++I2 |
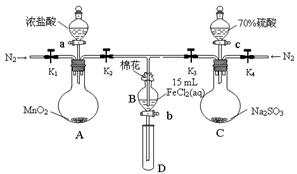
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略)。
实验过程:
①检查装置气密性后,在各仪器中添加相应试剂。
②打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
③打开活塞a,滴加一定量的浓盐酸,加热A。
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑦更换试管D,重复过程⑤,检验B溶液中的离子。
试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是 。
(2)C中发生反应的化学方程式为 。
(3)B中的棉花通常会浸润 试剂;实验②中通入N2的作用是 。
(4)甲、乙、丙三位同学分别完成了上述实验,
他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”、“乙”或“丙”)。
| |
过程⑤ B溶液中含有的离子 |
过程⑦ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(5)进行实验过程⑥时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立: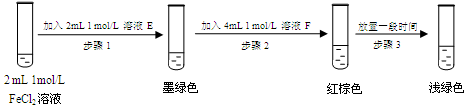
① 溶液E和F分别为 、 。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
在淀粉—碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO->I2>SO |
| B.漂白粉溶液可使淀粉碘化钾试纸变蓝 |
| C.次氯酸钠可以与亚硫酸钠共存 |
| D.向氯水中加入亚硫酸钠溶液,氯水褪色 |
根据表中信息判断,下列选项正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-… |
Cl2、Mn2+… |
A.第①组反应的其余产物只有O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子10 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3 +6HCl=3Cl2+KCl +3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
| A.该未知物X为Na2SO4 |
| B.该反应的氧化剂是KIO3 |
| C.该反应中,发生氧化反应的过程是KIO3→I2 |
| D.由反应可知还原性强弱顺序为:Na2SO3>I2 |
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z板上有H2放出,若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子,则这四种金属的活动性由强到弱的顺序为
| A.X > Z > Y > M | B.X > Y > Z > M |
| C.M > Z > X > Y | D.X > Z > M > Y |
某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,进行如下实验:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适量的稀硫酸,溶液立即变蓝;
(1)写出实验①中发生反应的离子方程式 。
实验②:取适量实验①后的溶液,滴加4 mL 0.5 mol·L—1的亚硫酸钠溶液,蓝色恰好完全褪去。
(2)实验②化学反应中转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
实验③:取适量实验①后的溶液,继续滴加次氯酸钠溶液,溶液由蓝色变为无色,生成物之一为食盐加碘的原料。
(4)写出实验③中发生反应的离子方程式 。
(5)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-= Cu2+,还原反应式:2Fe3++2e-= 2Fe2+。据此,将反应2Al+2OH—+2H2O = 2AlO2—+3H2↑拆写为两个“半反应式”:氧化反应式: ,还原反应式: 。
已知2Fe3++2I-=2Fe2++I2 2Fe2++Cl2=2Fe3++2Cl-则有关离子的还原性由强到弱的顺序为
| A.Cl->Fe2+>I- | B.Fe2+>I->Cl- |
| C.I->Fe2+>Cl- | D.Fe2+>Cl->I- |
向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,可得到剩余的固体物质。已知:Na2SO3+I2+H2O===Na2SO4+2HI,则剩余固体物质的组成可能是
①NaCl、Na2SO4②NaCl、NaBr、Na2SO4③NaCl、Na2SO4、I2④NaCl、NaI、Na2SO4
| A.①② | B.②④ | C.①③ | D.③④ |
现有下列反应式,据两式判断,下列各组离子中,氧化性由强到弱的排列顺序正确的是
(1)2Fe3++2I— 2Fe2++I2 (2)Br2+2Fe2+ 2Fe3++2Br—
| A.Br2>Fe2+> I2 | B.Br2>Fe3+> I2 |
| C.I2> Br2>Fe3+ | D.Fe3+> Br2> I2 |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+ 下列说法正确的是
| A.H2O2生产过程要严格避免混入Fe2+ |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
| C.在H2O2分解过程中, Fe2+和Fe3+的总量发生变化 |
| D.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
A2、B2、C2 3种单质和它们离子间能发生下列反应2A—+C2=2C—+ A2,2C—+ B2 = 2B— + C2,若X—能与C2发生反应2X— + C2 = 2C— + X2 有关说法中不正确的是
| A.氧化性B2>C2>A2 | B.还原性X->C->B- |
| C.X2 与B— 能发生反应 | D.X2 与B— 不能发生反应、 |
向溴化铁溶液中加入足量新制氯水,将溶液蒸干并充分灼烧,最后得到的固体是
| A.Fe2O3 | B.FeCl3 | C.FeCl3 和Br2 | D.Fe(OH)3 |
为验证氧化性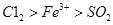 ,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。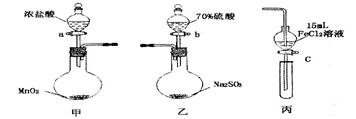
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_______ _____。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______ _______。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下: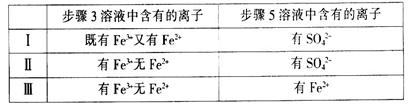
上述实验结果一定能够证明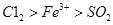 的是______(填“I”、“II”或“III”)。
的是______(填“I”、“II”或“III”)。