天津市宝坻区四校高一11月联考化学试卷
下列物质所含有的原子个数为阿伏加德罗常数的是
| A.1mol Cl2 | B.0.5mol CO2 | C.1 mol氖气 | D.0.5mol SO3 |
Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
| A.Na2CO3是碳酸盐 | B.Na2CO3是盐 |
| C.Na2CO3是钠盐 | D.Na2CO3是碱 |
下列说法错误的是
| A.利用丁达尔效应可区分淀粉溶液与葡萄糖溶液 |
| B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 |
| C.用过滤法无法除去Fe(OH)3胶体中的FeCl3 |
| D.向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质 |
下列物质分类正确的是
| A.Cu(OH)2难溶于水,属于非电解质 |
| B.NH4Cl组成中不含金属离子,不属于盐 |
| C.SO2溶于水能导电,SO2属于电解质 |
| D.HCl气体溶于水电离成H+和Cl-,属于电解质 |
在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是
A.1︰2 B.2︰1 C.2︰3 D.3︰2
在呼吸面具和潜水艇里,过滤空气的最佳物质是
| A.NaOH | B.Na2O2 | C.Na | D.Al |
下列离子方程式正确的是
| A.钠与水反应 Na + H2O ="==" Na++ OH– + H2↑ |
| B.AlCl3溶液中加过量氨水 Al3+ + 3OH– ="==" Al(OH)3↓ |
| C.向氯化亚铁中通入氯气 Fe2++ Cl2="==" Fe3++ 2Cl– |
| D.铝粉投入到NaOH溶液2Al + 2OH– + 2H2O="==2" AlO2– + 3H2↑ |
向下列溶液中滴加稀硫酸,生成沉淀,继续滴加稀H2SO4沉淀又溶解的是
| A.Na2CO3 | B.BaCl2 | C.Fe(OH)3胶体 | D.Na2SO4 |
下列实验操作中错误的是
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.称量NaOH,称量物放在小烧杯中置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
下列关于合金的说法正确的是
①合金至少含两种金属 ②合金中元素以化合物形式存在
③合金的熔点比组成成分低 ④合金一定是混合物⑤铁锈是一种铁合金
| A.①② | B.②③⑤ | C.③④ | D.③ |
下列物质与铁反应后的生成物,能与KSCN溶液作用生成红色溶液的是
| A.盐酸 | B.氯气 | C.CuSO4溶液 | D.稀硫酸 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B.在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| D.标准状况下,11.2LH2O含有的分子数为0.5NA |
下列溶液Cl-物质的量浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-物质的量浓度相等的是
| A.150 mL 1 mol·L-1NaCl溶液 | B.75 mL 1.5 mol·L-1CaCl2溶液 |
| C.150 mL 3 mol·L-1KClO3溶液 | D.50 mL 3 mol·L-1MgCl2溶液 |
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是
| A.950mL,111.2g | B.500mL,117g | C.1000mL,117g | D.任意规格,111.2g |
镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
| A.AlO2─ | B.Cu2+ | C.Al3+ | D.Mg2+ |
需加入氧化剂才能实现的是
| A.Fe3+→Fe2+ | B.Cl-→Cl2 | C.CuO→Cu | D.H2SO4→BaSO4 |
氧化还原反应与四种基本类型反应的关系如下图所示,
则下列化学反应属于区域3的是
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O +CO2↑ Na2CO3+H2O +CO2↑ |
C.CuO+CO  Cu + CO2 Cu + CO2 |
| D.Zn +H2SO4 = ZnSO4 + H2↑ |
下列离子在水溶液中,无色且能大量共存的是
| A.Fe3+ 、K+、NO3- 、Cl- | B.Ba2+ 、K+、Cl- 、OH- |
| C.H+、Mg2+ 、HCO3- 、SO42- | D.Na+、K+、MnO4- 、NO3- |
下列各组物质只用胶头滴管和试管不能鉴别的是
| A.KOH溶液与AlCl3溶液 | B.MgCl2溶液与氨水 |
| C.NaAlO2溶液与盐酸 | D.Na2CO3溶液与盐酸 |
A2、B2、C2 3种单质和它们离子间能发生下列反应2A—+C2=2C—+ A2,2C—+ B2 = 2B— + C2,若X—能与C2发生反应2X— + C2 = 2C— + X2 有关说法中不正确的是
| A.氧化性B2>C2>A2 | B.还原性X->C->B- |
| C.X2 与B— 能发生反应 | D.X2 与B— 不能发生反应、 |
可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是
| A.加热时无气体放出 |
| B.滴加盐酸时有气泡放出 |
| C.溶于水后滴加BaCl2稀溶液有白色沉淀生成 |
| D.溶于水后滴加澄清石灰水有白色沉淀生成 |
金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是
| A.HCl | B.NaCl | C.FeCl3 | D.Na2SO4 |
某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是
| A.K+、Mg2+、Cl-、SO42- | B.Na+、NH4+、SO42-、HCO3- |
| C.Na+、K+、SO42-、Cl- | D.K+、Na+、NO3-、AlO2- |
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
| A.KSCN | B.BaCl2 | C.HCl | D.NaOH |
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
| A.70% | B.52.4% | C.47.6% | D.30% |
标准状况下,112 mL某气体的质量为0.14 g,则其摩尔质量为________,分子数为____________。
怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)NaHCO3溶液中混有Na2CO3
(3)FeCl2溶液中混有CuCl2
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加蒸馏水至刻度线 |
| D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为__________ __________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。
(5)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同)。②未经冷却趁热将溶液注入容量瓶中,________。③摇匀后发现液面低于刻度线再加水,________。④容量瓶中原有少量蒸馏水,________。
如图在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体,并靠近火焰点火。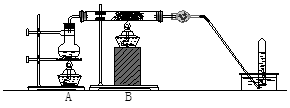
(1)试管收集到的气体是______,B中发生反应的化学方程式为______________________________。
(2)干燥管内可装入的试剂是____________,其作用是____________。
(3)玻璃管中石棉绒的作用是____________。实验开始时应先点燃____________,(答A处或B处酒精灯,下同)实验结束时,应先熄灭____________。
已知有以下物质相互转化:
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式) ;
(2)写出B的化学式 ,F的化学式 ;
(3)写出由G转变成H的化学方程式 ;
(4)写出检验I溶液中阳离子的离子方程式 ;
向I溶液中加入A的有关离子反应方程式是 。
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
请回答:
⑴W的化学式是____________________。
⑵X与Y在溶液中反应的离子方程式是_______________________________。
⑶①将4.48 L(已折算为标准状况)W通入100 mL3 mol/L的Y的水溶液后,溶液中的溶质是________。
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测
得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 g。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号