已知有以下物质相互转化: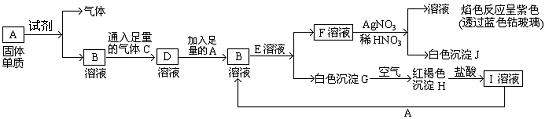
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式) ;
(2)写出B的化学式 ,F的化学式 ;
(3)写出由G转变成H的化学方程式 ;
(4)写出检验I溶液中阳离子的离子方程式 ;
向I溶液中加入A的有关离子反应方程式是 。
已知有以下物质相互转化:
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式) ;
(2)写出B的化学式 ,F的化学式 ;
(3)写出由G转变成H的化学方程式 ;
(4)写出检验I溶液中阳离子的离子方程式 ;
向I溶液中加入A的有关离子反应方程式是 。