锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3 + 3O2 + 6Fe = Sb4O6 + 6FeS ①
Sb4O6 + 6C =" 4Sb" + 6CO ②
关于反应①、②的说法正确的是( )
| A.反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| C.反应②说明高温下Sb的还原性比C强 |
| D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4∶3 |
在H2O2溶液中加入KI和H2SO4的混合溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;②H2O2+I2=2HIO;③H2O2+2HIO=I2+O2↑+2H2O。下列说法正确的是
| A.H2O2在上述3个反应中均做氧化剂 |
| B.H2O2氧化性强于HIO,还原性弱于I2 |
| C.上述过程中每生成1mol氧气,消耗1mol双氧水 |
| D.在反应后的溶液中加入淀粉,溶液呈现蓝色 |
已知在一般的氧化还原反应中,氧化性关系为:氧化剂>氧化产物,还原性:还原剂>还原产物,R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合( )
| A.R2+>X2+>Z2+>Y2+ | B.X2+>R2+>Y2+>Z2+ |
| C.Y2+>Z2+>R2+>X2+ | D.Z2+>X2+>R2+>Y2+ |
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法不正确的是 ( )
| A.x="4" |
| B.每生成1 mol Fe3O4,反应共转移2mol e- |
| C.Fe2+和S2O32-都是还原剂 |
| D.1 mol S2O32-被氧化时,被S2O32-还原的O2为0.25mol |
以白云石(CaCO3·MgCO3)为原料冶炼金属镁的反应工艺涉及以下两个反应:
|
|
①CaCO3·MgCO3 MgO·CaO+2CO2↑;②2(MgO·CaO)+Si 2CaO·SiO2+2Mg↑
对①②两个反应的说法疋确的是 ( )
| A.在敞口容器中有利于反应①的进行 |
| B.反应①能进行,说明该反应△H<O |
| C.在真空条件下有利于反应②的进行 |
| D.反应②能进行,说明Si的还原性比Mg强 |
下列反应中,HCl既表现出酸性又表现出还原性的是
|
| A.Zn + 2HCl ="" ZnCl2 + H2↑ △ |
B.2HCl ="===" H2 ↑+ Cl2↑ |
C.MnO2 + 4HCl ="===" MnCl2 + Cl2 ↑ + 2H2O |
| D.HCl + AgNO3 ="==" AgCl ↓ + HNO3 |
已知有如下反应:①2Fe3++2I-===2Fe2++I2 ②2Fe2++Br2===2Fe3++2Br-
③2Fe(CN)+I2===2Fe(CN)+2I-,试判断氧化性强弱顺序正确的是
| A.Fe3+>Br2>I2>Fe(CN) |
| B.Br2>I2>Fe3+>Fe(CN) |
| C.Br2>Fe3+>I2>Fe(CN) |
| D.Fe(CN)>Fe3+>Br2>I2 |
已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-,②ClO3-+5Cl-+6H+=3Cl2+3H2O,③2FeCl3+2KI=2FeCl2+2KCl+I2,④2FeCl2+Cl2=2FeCl3。下列各微粒氧化能力由强到弱的顺序正确的是
| A.ClO3->BrO3->Cl2>Fe3+>I2 | B.BrO3->Cl2>ClO3->I2>Fe3+ |
C.BrO3->ClO3->Cl2>Fe3+>I2 | D.BrO3->ClO3->Fe3+>Cl2>I2 |
下列反应中,通入的气体只作氧化剂的是
| A.SO2通入H2S溶液中 | B.Cl2通入NaOH溶液中 |
| C.SO2通入KOH溶液中 | D.SO2通入氯水中 |
常温下,在溶液中可发生以下反应:
①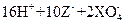 ===
===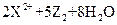 ,
,
②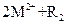 ===
=== ,③
,③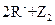 ===
=== ,
,
由此判断下列说法错误的是( )
A.还原性强弱顺序为: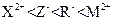
B.Z元素在反应①中被氧化,在③中被还原
C.常温下可发生反应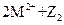 ===
===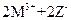
D氧化性强弱顺序为: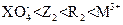
在一定条件下,硫酸铵的分解反应为:(NH4)2SO4→N2↑+NH3↑+SO2↑+SO3+H2O(未配平),下列说法正确的是
| A.反应中,硫元素部分被氧化,氮元素部分被还原 |
| B.反应中每产生1molN2必同时产生2molSO2 |
| C.反应中每转移1mol电子就会生成0.5molSO2 |
| D.当(NH4)2SO4的计量数为4时,产生NH3和SO2的物质的量之比为1:3 |