Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推。
(1)实验室用MnO2制备Cl2的反应中氧化剂是 ,氧化产物是 。将17.4g MnO2与足量的浓盐酸反应,则被氧化的HCl的物质的量为 。
(2)将溴水滴入KI溶液中的化学方程式为 。
(1)已知:2Fe3++2I-===2Fe2++I2, 2Fe2++Br2===2Fe3++2Br-。
①根据以上方程式比较Fe2+、Br-、I-还原性的强弱
②含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________
(2)在硫酸铝、硫酸钾和明矾的1 L混合溶液中,如果SO42-浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解,反应后混合溶液中K+的浓度为_______mol/L
工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
| A.氧化性:H2SeO4>Cl2>H2SO3 |
| B.酸性:H2SO4>H2SeO4 |
| C.析出1mol硒需要消耗标准状况下22.4 L SO2 |
| D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |
在常温下发生下列反应:
①16H++10Z-+2XO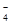 ="=" 2X2++5Z2+8H2O
="=" 2X2++5Z2+8H2O
②2A2++B2 ="=" 2A3++2B-
③2B-+Z2 ="=" B2+2Z-,根据上述反应,判断下列结论中错误的是( )
| A.溶液中可能发生反应:Z2+2A2+=2A3++2Z- |
| B.Z在①③反应中作还原剂 |
C.氧化性强弱顺序为XO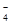 >Z2>B2>A3+ >Z2>B2>A3+ |
D.X2+是XO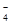 的还原产物 的还原产物 |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,经酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉—KI溶液中,溶液变蓝。
下列判断不正确的是( )
| A.化合物KCrO2中Cr元素为+3价 | B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 | D.实验③证明氧化性:Cr2O72- > I2 |
根据下列三个反应判断有关物质(或微粒)还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO十+2H2O+Fe(NO3)3
| A.H2SO3 >I-> Fe2+ >NO | B.I->Fe2+> H2SO3 >NO |
| C.Fe2+ >I-> H2SO3 >NO | D.NO>Fe2+>H2SO3 >I- |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
溴乙烷与NaOH溶液共热后,加入AgNO3溶液 |
未出现淡黄色沉淀 |
溴乙烷没有水解 |
| C |
向等浓度的KCl、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgCl)<Ksp(AgI) |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静止 |
下层液体显紫红色 |
氧化性:Fe3+>I2 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 → b O2↑+ c Cl2↑+ d HClO4+ e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法错误的是
| A.由反应可确定:氧化性HClO3>HClO4 |
| B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+ I2+ 6H2O→ 12H++ 8Cl-+ 2IO3- |
| C.若氯酸分解所得的混合气体的平均摩尔质量为47.6g/ mol,则反应方程式可表示为:26HClO3 → 15O2↑+ 8C12↑+ 10HClO4+ 8H2O |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
| A.木已成舟 | B.铁杵成针 | C.蜡炬成灰 | D.滴水成冰 |
(1)已知反应MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,通过计算回答:用双线桥标出反应中电子转移的方向和数目 ,参加反应的HCl的物质的量为 ,其中被氧化的HCl的质量 。
MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,通过计算回答:用双线桥标出反应中电子转移的方向和数目 ,参加反应的HCl的物质的量为 ,其中被氧化的HCl的质量 。
(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、 H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________。
②已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_______,写出一个包含上述七种物质的氧化还原反应方程式(不需配平)_________ ________。
③根据上述反应可推知( )
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
A2、B2、C2 3种单质和它们离子间能发生下列反应2A-+C2=2C-+A2、2C-+B2=2B-+C2,若X-能与C2发生反应2X-+C2=2C-+X2,有关说法中不正确的是
| A.氧化性B2>C2>A2 | B.还原性X->C->B- |
| C.X2与B-能发生反应 | D.X2与B-不能发生反应 |
下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平),
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为________________。
(2)反应②中,氧化产物与还原产物的质量比为____________。
(3)请将反应③配平:__KMnO4+__HCl(浓)=__KCl十__MnCl2+__Cl2↑+__H2O
(4)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为_________。
(5)已知反应④:4HCl(g)+O2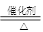 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为________________。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为________________。
已知I-、Fe2+、SO2、和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<H2O2<Fe2+<I-<SO2,则下列反应不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+H2SO4=SO2+O2↑+H2O | D.2Fe3++2I-=2Fe2++I2 |
G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G→Q+NaCl ②Q+H2O→X+H2
③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
则G、Q、X、Y、Z这五种化合物中氯元素的化合价由低到高的顺序为
| A.QGZYX | B.GYQZX | C.GYZQX | D.ZXGYQ |