“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g)= H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 ________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb下列有关说法正确的是:(Pb的相对原子质量:207)
| A.正极反应式:Ca+2Cl- - 2e-=CaCl2 |
| B.常温时,在正负极间接上电流表或检流计,指针不偏转。 |
| C.放电过程中,Li+向负极移动 |
| D.每转移0.1mol电子,理论上生成20.7gPb |
有一种基于乙醇酸性燃料电池原理设计的酒精检测仪,其原理是通过将乙醇氧化为乙酸来测定血液中乙醇的含量。下列有关说法正确的是
| A.电池工作时消耗5.6 L O2,转移电子为1 mol |
| B.检测时,电解质溶液中的H+向负极移动 |
| C.正极上发生的反应为:O2+4e-+2H2O=4OH- |
| D.负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在
其中自由移动。下列有关叙述正确的是
| A.电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O |
| B.电极b是正极,O2-由电极b流向电极a |
| C.瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D.当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) 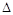 H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) 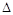 H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l) 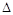 H= 。(请用含有
H= 。(请用含有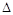 H1、
H1、 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。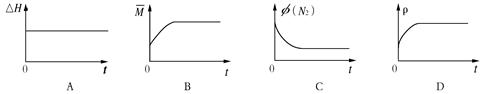
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为 g(假设溶液电解前后体积不变)。
用酸性氢氧燃料电池(甲池)为电源进行电解的实验装置(乙池,一定条件下可实现有机物的电化学储氢)如下图所示.甲池中C为含苯的物质的量分数为10%的混合气体,D为l0mol混合气体其中苯的物质的量分数为24%(杂质不参与反应),E为标准状况下2. 8mol气体(忽略水蒸汽),下列说法正确的是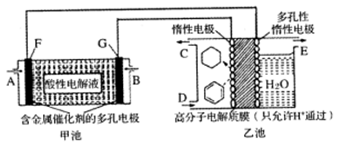
| A.甲池中A处通入H2,E处有O2放出 |
| B.甲池中H+由F极移向G极 |
| C.乙池中阴极区只有苯被还原 |
| D.导线中共传导11.2mol电子 |
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
CO (g)+2H2 (g) CH3OH (g)
CH3OH (g)
(1)在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入 催化剂后在250 ℃开始反应,
CO的平衡转化率与温度、压强的关系如图所示。容器中M、N两点气体的物质的量之比为 。M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(2)通过压力计监测上述容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/Mpa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率为 ,该温度下平衡常数K= 。
(3)下列描述中能说明上述反应已达平衡状态的是 。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300 mL NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为__________。
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH- 2CO32-+6H2O,则下列说法正确的是
2CO32-+6H2O,则下列说法正确的是
| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32- + 6H2O |
据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂为电极,导电离子是H+。下列对该燃料电池的描述正确的是
①正极反应为:O2+4H++4e—= 2H2O ②电子由负极流向正极
③总的化学反应为:2H2+O2 2H2O ④氢离子通过电解质向正极移动
2H2O ④氢离子通过电解质向正极移动
A.①②③ B.①②④ C.②③④ D.①②③④
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:
该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠( 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。
②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
【改编】LED系列产品是被看好的一类节能新产品, 下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
| A.a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O |
| B.b处通入氧气,为电池的正极 |
| C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替 |
| D.P-型半导体连接的是电池负极 |
某充电宝锂离子电池的总反应为: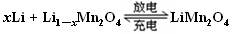 ,某手机镍氢电池总反应为:
,某手机镍氢电池总反应为: (M为储氢金属或合金),有关上述两种电池的说法不正确的是
(M为储氢金属或合金),有关上述两种电池的说法不正确的是
| A.锂离子电池放电时Li+向正极迁移 |
| B.镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-="=" Ni(OH)2+OH- |
| C.上图表示用锂离子电池给镍氢电池充电 |
| D.锂离子电池充电时,阴极的电极反应式:LiMn2O4—xe-="=" Li1-xMn2O4+ xLi+ |
【改编】磷酸铁锂电池的电池的内部结构如图所示。左边是磷酸铁锂材料作为电池的正极,由铝箔与电池正极连接,中间是聚合物的隔膜,它把正极与负极隔开,但锂离子Li+可以通过而电子不能通过,右边是由石墨组成的电池负极,由铜箔与电池的负极连接。电池的上下端之间是电池的电解质,电池由金属外壳密闭封装。电池的总反应为:

下列关于电池的说法不正确的
| A.磷酸铁锂电池放电时,锂离子从负极中脱离出来,经过电解液,穿过隔膜回到正极材料中 |
| B.放电时负极反应:LixC6-xe- ="=" 6C+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料) |
| C.充电时的阳极反应:LiFePO4 -xe-="=" Li1-xFePO4+xLi+ |
| D.若用该电池电解精炼粗铜,阳极质量减少12.8g 时,则电池中通过聚合物隔膜的Li+数为0.4NA |
【改编】用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是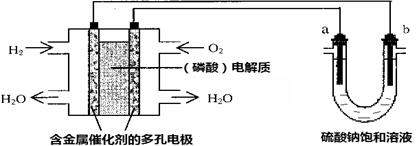
| A.电池工作时,正极反应式为:O2 + 4H++ 4e-= 2H2O |
B.电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.01g O2 时,b 极周围会产生0.02g H2 |