LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li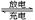 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料的质量不变 |
| D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
| A.甲醇 | B.天然气 | C.氢气 | D.液化石油气 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
由此可知,该电池放电时的正极材料是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
已知空气一锌电池的电极反应为:锌片, Zn+2OH--2e- ZnO+H2O,
ZnO+H2O,
石墨 1/2O2+H2O+2e- 2OH-。据此判断锌片是
2OH-。据此判断锌片是
| A.负极,并被氧化 | B.负极,并被还原 |
| C.正极,并被氧化 | D.正极,并被还原 |
锌锰干电池在放电时,电池总反应方程式可以表示为:
Zn + 2MnO2 + 2NH4+= Zn2++ Mn2O3 + 2NH3 + H2O在此电池放电时,正极(碳棒)上发生反应的物质是
| A.Zn | B.碳棒 | C.MnO2和NH4+ | D.Zn2+和NH4+ |
电池是人类生产和生活中重要的能量来源。各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
Ⅰ、碳是地球上含量丰富的元素,其氧化物的研究有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 _______________;
(2)试在原图基础上画出加入正催化剂后该反应在反应过程中的能量变化示意图(进行必要的标注)。
Ⅱ、全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。
全钒液流电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子【V2+ (紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)】为正极和负极电极反应的活性物质
电池总反应为VO2++V3++H2O V2++VO2++2H+。
V2++VO2++2H+。
下图是钒电池基本工作原理示意图:
请回答下列问题:
(1)放电时的正极反应式为____
(2)充电时的阴极反应式为_________ ___ _____,
充电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)放电过程中氢离子的作用是______ ;
若充电时转移电子的数目为6.02×1023,则左槽溶液中H+的变化量为 mol 。
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电过程按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2,
Cd(OH)2 + 2Ni(OH)2,
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+ OH—="=" NiOOH + H2O |
| B.充电过程中镉元素被氧化 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH—向正极移动 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流。关于此燃料电池的下列叙述正确的是
| A.通入CH 4的电极为正极 |
| B.正极的电极反应式为:2O2 +8e - +4H2O=8OH- |
| C.若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O 2被氧化 |
| D.通入甲烷的电极的电极反应式为:CH 4 +2O 2 + 4e - =CO 2+ 2H2O |
下列叙述正确的是
| A.铅蓄电池放电过程中,正极质量增加,负极质量减小 |
| B.将0.1 mol·L-1的NH3·H2O溶液加水稀释, c(NH4+)/c(NH3·H2O)比值减小 |
| C.NaHCO3溶于水,溶液中存在电离平衡。 |
| D.CaCO3(s)===CaO(s)+CO2(g),ΔH>0,该反应在任意温度下都能自发进行。 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2+2H2O+4e-===4OH-
D.d极上发生氧化反应,右端装置B中的H+可以通过隔膜进入A
某二次电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
| A.K+从右到左通过离子交换膜 |
| B.A的电极反应式为:3I--2e-= I3- |
| C.当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) |
| D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
(17分)碳及其化合物与人类生产、生活密切相关。(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。
已知:C(s)+1/2O2(g)=CO(g)△H1=-126.4kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
S(s)+O2(g)=SO2(g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式为____________。
(2)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g) △H=-90.8KJ·mol-1。
CH3OH(g) △H=-90.8KJ·mol-1。
①在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是______℃;该温度下上述反应的化学平衡常数为_______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________;
②在密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状。当改变某一反应条件后,下列变化能说明平衡一定向正反应方向移动的是______(填序号)。
| A.正反应速率瞬间增大,后逐渐减小 |
| B.混合气体的密度增大 |
| C.化学平衡常数K值增大 |
| D.反应物的体积百分含量增大 |
(3)一种新型CO燃料电池工作原理如图所示。
①负极电极反应式为_______________________;
②电极A处产生的CO2有部分参与循环利用,其利用率为____________。