某全钒新型电池,以惰性材料作电极,在电解质溶液中发生电池总反应为:
下列说法正确的是
| A.当电池无法放电时,只要更换电解质溶液,不用外接电源进行充电就可正常工作 |
B.放电时,负极反应为 |
| C.充电时,阳极附近溶液由绿色逐渐变为紫色 |
| D.放电过程中,正极附近溶液的pH变小 |
Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源。电池的总反应可表示为:Mg+2AgCl=MgCl2+2Ag。下列关于该电池说法错误的是
| A.该电池工作时,正极反应为:2AgCl+2e-=2Cl-+2Ag |
| B.镁电极作该电池负极,负极反应为:Mg-2e-=Mg2+ |
| C.当有24g Mg被氧化时,有108 g Ag被还原 |
| D.装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
氢氧燃料电池已用于航天飞机。以硫酸溶液为电解质溶液,电子经外电路、质子经内电路到达另一电极后发生电极反应,这种电池在使用时的电极反应如下:
2H2 - 4e- = 4H+ O2 + 4e- + 4H+ = 2H2O
下列说法不正确的是
| A.右电极为电池正极,b处通入的物质是氧气 |
| B.左电极为电池负极,a处通入的物质是氧气 |
| C.供电时的总反应为:2H2 + O2 = 2H2O |
| D.H2在负极发生氧化反应 |
关于铜锌原电池和电解CuCl2溶液的装置(如右图),下列说法正确的是 
| A.锌是负极,铜片上有气泡产生,电流从锌片经导线流向铜片 |
| B.铜片质量逐渐减少,氢离子在铜片表面被还原 |
| C.d为阳极,电极反应为:2Cl—-2e—=Cl2↑ |
| D.电解过程中, d电极质量增加 |
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( )
| A.Y>Z>W>X | B.Z>Y>W>X |
| C.W>Z>Y>X | D.X>Y>Z>W |
燃料电池的突出优点是把化学能直接转变为电能,而不经过热能中间形式,现已广泛使用。如甲烷燃料电池,其电极反应为:负极:CH4+10OH- -8e- = CO32-+7H2O
正极:2O2+8e-+4H2O = 8OH-。今欲得27g水,则电池中电子转移的物质的量为
| A.1mol | B.2mol | C.4mol | D.6mol |
二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
| 沉淀物 |
CuS |
ZnS |
MnS |
FeS |
|
|
| Ksp |
8.5×10-45 |
1.2×10-23 |
1.4×10-15 |
3.7×10-14 |
|
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为:
。
(2)滤渣A的主要成分为 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为 。
(5)从废旧碱性锌锰电池中可回收利用的物质有 (写两种)。
据报道,我国拥有完全自主产权的氢氧燃料电池车已在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-===4OH- |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.电解质溶液中的OH-向负极移动 |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移 |
世博会中国馆、主题馆等建筑使用光伏并网发电,总功率达4兆瓦,是历届世博会之最。并且使用半导体(LED)照明,节约大量能源。已知发出白光的LED 是由GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的。下列有关叙述正确的是
A.光伏电池是将太阳能直接转变为电能
B.图中 N 型半导体为正极, P 型半导体为负极
C.电流从 a 流向 b
D.LED 是新型有机高分子材料
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:PbO2 (s)+Pb(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次性电池 |
| D.电池放电时,溶液酸性增强 |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li+ + FeS + 2e- ="=" Li2S + Fe ,有关该电池的下列叙述中正确的是
| A.该电池的电池反应式为:2Li + FeS ="=" Li2S + Fe |
| B.Li-Al合金在电池中作为正极材料 |
| C.负极的电极反应式为:Al — 3e- ="=" Al3+ |
| D.Li-Al/FeS电池中,电子经外电路流入Li-Al极 |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极:Pb + SO42- → PbSO4 + 2e 正极:PbO2 + 4H+ + SO42- + 2e → PbSO4 + 2H2O若为电解池提供0.1mol电子,这时电池内消耗的H2SO4的物质的量至少是( )
| A.0.025mol | B.0.050mol | C.0.10mol | D.0.20mol |
现在所见的燃料电池主要有如下的四种,下面是这四种燃料电池的工作原理示意图,其中正极的反应产物为水的是
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示。下列叙述中正确的是
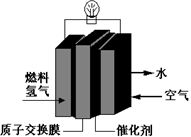
| A.通入空气的电极发生氧化反应 |
| B.通入氢气的电极为正极 |
| C.正极的电极反应式为:O2+4H+-4e-==2H2O |
| D.总反应式为:O2+2H2==2H2O |
下列说法正确的是
| A. |
一定温度下,反应
|
| B. |
水解反应
|
| C. | 铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D. |
对于反应
|