2011年全国统一高考化学试卷(江苏卷)
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术; ④田间焚烧秸秆;⑤推广使用节能环保材料。
④田间焚烧秸秆;⑤推广使用节能环保材料。
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
下列有关化学用语表示正确的是
| A. |
的电子式:
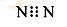
|
| B. |
的结构示意图:
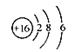
|
| C. |
质子数为53,中子数为78的碘原子:
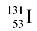
|
| D. |
邻羟基苯甲酸的结构简式:
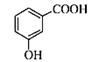
|
下列有关物质的性质和该性质的应用均正确的是
| A. | 常温下浓硫酸能是铝发生钝化,可在常温下作用铝制贮藏贮运浓硫酸 |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D. | 铜的金属活泼性比铁的若,可在海轮外壳上装若干铜块以减缓其腐蚀 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A. | 1.0 的 溶液: 、 、 、 |
| B. | 由水电离产生的 =1.0×10 - 12 的溶液: 、 、 、 |
| C. | 甲基橙呈红色的溶液: 、 、 、 |
| D. | 与铝反应产生大量氢气的溶液: 、 、 、 |
短周期元素
、
、
、
、
在元素周期表中的相对位置如图1所示。下列说法正确的是
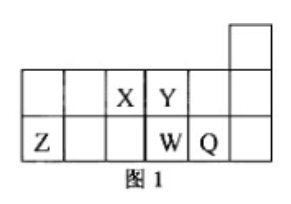
| A. | 元素 与元素 的最高正化合价之和的数值等于8 |
| B. | 原子半径的大小顺序为: |
| C. | 离子 和 的核外电子数和电子层数都不相同 |
| D. | 元素 的最高价氧化物对应的水化物的酸性比 的强 |
下列表示对应化学反应的离子方程式正确的是()
| A. | 溶液与 的反应: |
| B. | 与水的反应: |
| C. | 醋酸溶液水垢中的 反应: |
| D. | 向 溶液中通入过量 : |
下列有关实验原理或实验操作正确的是
实验室用如图所示装置制取少量氨气

实验室用如图所示装置出去中的少量

设为阿伏伽德罗常数的值。下列叙述正确的是
是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是

25℃,在水中的溶解度比的大
石灰乳与的反应中,既是氧化剂,又是还原剂
常温下干燥的能用钢瓶贮存,所以不与铁反应
图4所示转化反应都是氧化还原反应
下列图示与对应的叙述相符的是

 曲线
曲线
β--紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。

下列说法正确的是()
| A. | β--紫罗兰酮可使酸性 溶液褪色 |
| B. | 1mol中间体 最多能与2mol 发生加成反应 |
| C. | 维生素A 1易溶于 溶液 |
| D. | β--紫罗兰酮与中间体 互为同分异构体 |
下列说法正确的是
下列有关实验原理、方法和结论都正确的是
 +
,向盛有
溶液的试管中加入适量
,振荡静置后
层显紫色,说明
在
中的溶解度比在水中的大
+
,向盛有
溶液的试管中加入适量
,振荡静置后
层显紫色,说明
在
中的溶解度比在水中的大
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A. | 在0.1 溶液中: |
| B. | 在0.1 溶液中: |
| C. |
向0.2
溶液中加入等体积0.1
溶液:
c |
| D. | 常温下, 和 混合溶液[ ]: |
700℃时,向容积为2L的密闭容器中充入一定量的和,发生反应:
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
||
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是()
| A. |
反应在t1min内的平均速率为 |
| B. |
保持其他条件不变,起始时向容器中充入0.60mol和1.20 mol,到达平衡时,n(CO2)=0.40 mol。 |
| C. |
保持其他条件不变,向平衡体系中再通入0.20mol,与原平衡相比,达到新平衡时转化率增大,的体积分数减小。 |
| D. |
温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
以硫铁矿(主要成分为)为原料制备氯化铁晶体()的工艺流程如下:
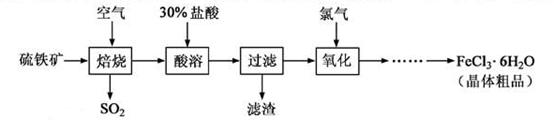
回答下列问题:
(1)在一定条件下,转化为 的反应为,该反应的平衡常数表达式为=;过量的与溶液反应的化学方程式为
的反应为,该反应的平衡常数表达式为=;过量的与溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化后时,发生的主要反应的离子方程式为;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为(写化学)。
敌草胺是一种除草剂。它的合成路线如下:

回答下列问题:
(1)在空 气中久置,由无色转变为棕色,其原因是。
气中久置,由无色转变为棕色,其原因是。
(2)分子中有2个含氧官能团,分别为和 填官能团名称)。
(3)写出同时满足下列条件的的一种同分异构体的结构简式:。
①能与金属钠反应放出;②是萘( )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧。
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧。
(4)若不经提纯,产物敌草胺中将混有少量副产物(分子式为),是一种酯。的结构简式为 。
(5)已知: ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
是银锌碱性电池的正极活性物质,可通过下列方法制备:在加入适量 溶液,生成沉淀,保持反应温度为80,边搅拌边将一定量溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
+回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是.
(2)银锌碱性电池的电解质溶液为溶液,电池放电时正极的 转化为,负极的转化为,写出该电池反应方程式:.
(3)准确称取上述制备的样品(设仅含和)2.558,在一定的条件下完全分解为和,得到224.0(标准状况下)。计算样品中的质量分数(计算结果精确到小数点后两位)。
高氯酸铵()是复合火箭推进剂的重要成分,实验室可通过下列反应制取
 (1)若用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是。
(1)若用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是。
(2)反应得到的混合溶液中和的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多晶体的实验操作依次为(填操作名称) 、干燥。

(3)样品中的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:

步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用标准溶液滴定至终点,消耗标准溶液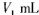
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml 溶液的玻璃仪器是。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是(填写步骤号)。
③为获得样品中的含量,还需补充的实验是
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。与反应生成和的热化学方程式为。
(2)热分解制氢时,常向反应器中通入一定比例空气,使部分燃烧,其目的是;燃烧生成的与进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:。
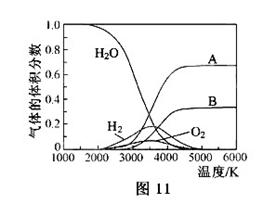
(3)的热分解也可得到,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中表示的物质依次是。
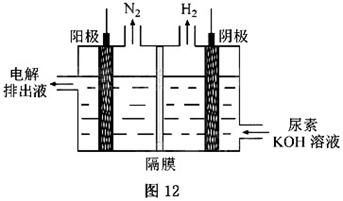
(4)电解尿素[]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为.
(5)是一种储氢合金。350℃时,与反应,生成和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。与反应的化学方程式为。
A.原子序数小于36的、、、四种元素,其中是形成化合物种最多的元素,原子基态时最外层电子数是其内层电子数的2倍,原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)分子中原子轨道的杂化类型为,1含有键的数目为。
(2)化合物的沸点比化合物的高,其主要原因是。
(3)元素的一种氧化物与元素的一种氧化物互为等电子体,元素的这种氧化物的分子式是。
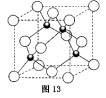
(4)元素的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物,反应的化学方程式为。
B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
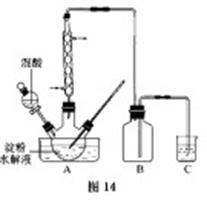
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65与98%的质量比为2:1.5)溶液
③反应3左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
↑↑
↑
↑
(1)检验淀粉是否水解完全所需用的试剂为
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
(3)装置用于尾气吸收,当尾气中=1:1时,过量的溶液能将,全部吸收,原因是用化学方程式表示)
(4)与用溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号