二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):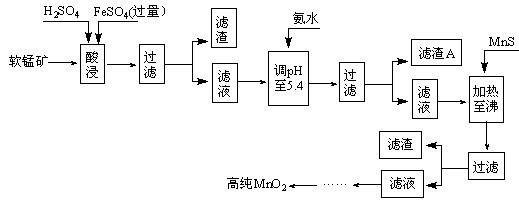
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
| 沉淀物 |
CuS |
ZnS |
MnS |
FeS |
|
|
| Ksp |
8.5×10-45 |
1.2×10-23 |
1.4×10-15 |
3.7×10-14 |
|
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为:
。
(2)滤渣A的主要成分为 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为 。
(5)从废旧碱性锌锰电池中可回收利用的物质有 (写两种)。
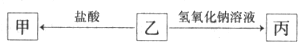
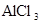
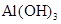
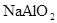
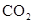


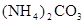
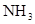
 的浓度为0.7 mol/L,则K+的物质的量浓度为
的浓度为0.7 mol/L,则K+的物质的量浓度为 粤公网安备 44130202000953号
粤公网安备 44130202000953号