用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
| A.0.6mol | B.0.2mol | C.0.3mol | D.0.4mol |
铅蓄电池的工作原理为Pb+PbO2+2H2SO4  2PbSO4+2H2O ,
2PbSO4+2H2O ,
根据下图,下列判断不正确的是( )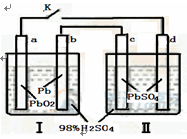
| A.K 闭合时,d电极反应式:PbSO4+2H2O-2e-= PbO2+4H++SO42- |
| B.K闭合时,Ⅱ中SO42-向d电极迁移 |
| C.当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.4 mol |
| D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: Cd(OH) +2Ni(0H)
+2Ni(0H)
 Cd+2NiOOH+2H
Cd+2NiOOH+2H O。由此可知,该电池充电时在阴极 上发生反应的是 ( )
O。由此可知,该电池充电时在阴极 上发生反应的是 ( )
A.Cd(OH)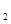 |
B.Ni(OH)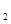 |
C.Cd | D.NiOOH |
全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统。电池反应为VO2++V2++2H+ VO2++V3++H20,下列说法正确的是
VO2++V3++H20,下列说法正确的是
A.该电池属于一次电池
B.电池工作时,H+由正极流向负极
C.电池放电时,负极的电极反应为VO2++H2O=VO2++2H++e-
D.电池充电时,阴极的电极反应为V3++e-=V2+
目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx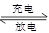 2Na+xS,以下说法正确的是)
2Na+xS,以下说法正确的是)
| A.放电时,Na 作正极,S极发生还原反应 |
| B.充电时,阳极发生的反应为:Sx2--2e-=xS |
| C.当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠23g |
| D.充电时钠极与外电源的正极相连 |
近来报道,含镍烤瓷牙可能导致人体出现不良反应。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知氧化性:Fe2+<Ni2+<Cu2+),下列叙述正确的是
| A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni |
| B.电解后,电解槽底部的阳极泥中只有Cu和Pt |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解过程中,阳极质量的减少与阴极质量的增加相等 |
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
V3++ VO2++H2O VO2++2H++V2+ 下列说法正确的是
VO2++2H++V2+ 下列说法正确的是
| A.放电时正极反应为:VO+2+2H++e—=VO2+ +H2O |
| B.放电时每转移2mol电子时,消耗1mol氧化剂 |
| C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 |
| D.放电过程中,H+由正极移向负极 |
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
下列叙述不正确的是
| A.该电池放电时的正极和充电时的阴极均发生还原反应 |
| B.放电时负极反应为:MH+OH——e— = M+H2O |
| C.充电时阳极反应为:NiOOH+H2O+e— = Ni(OH)2+OH— |
| D.放电时每转移1mol电子,正极有1molNiOOH被还原 |
铁镍蓄电池放电时的总反应为:Fe+Ni2O3+3 H2O  Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液 |
| B.电池的正极为Ni2O3、负极为Fe |
C.电池放电时,负极反应为Fe+20H一一2e一  Fe(OH)2 Fe(OH)2 |
| D.电池充电时,阳极附近溶液的pH升高 |
一种充电电池放电时的电极反应为
H2+2OH--2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当 为电池充电时,与外电源正极连接的电极上发生的反应是
为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 |
| C.H2的氧化 | D.Ni(OH) 2的氧化 |
铅蓄电池的示意图如图所示。下列说法正确的是
| A.放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-=PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42- |
| D.充电时,若N连电源正极,则该极生成PbO2 |
锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为: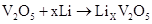 ,下列说法不正确的是
,下列说法不正确的是
| A.向外供电时,锂离子向负极移动 |
B.负极上反应的物质是锂,正极上反应的物质是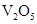 |
C.正极的电极反应为: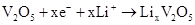 |
D.负极的电极反应为: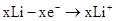 |
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是
| A.反应中MnO2是还原剂 |
| B.Ag的还原性比Na2Mn5O10强 |
| C.该反应中MnO2具有催化作用 |
| D.每生成1 mol Na2Mn5O10转移1 mol电子 |
下列关于碱性锌锰电池的判断正确的是 ( )
| A.Zn是正极, MnO2是负极 |
| B.工作时电子由MnO2经外电路流向Zn |
| C.Zn是负极, MnO2是正极 |
| D.Zn 电极发生还原反应,MnO2电极发生氧化反应 |