Li—SO2电池具有输出功率高且低温性能好的特点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动。电池总反应式为:2Li+2SO2 Li2S2O4。下列有关该电池的说法正确的是( )
Li2S2O4。下列有关该电池的说法正确的是( )
| A.放电Li+向正极移动 |
| B.该电池溶剂可用水替代 |
| C.该电池放电时,1mol SO2参与反应,转移2mol e- |
| D.充电阳极反应式为2Li++2SO2+2e-=Li2S2O4 |
用惰性电极电解MnO4溶液可得到MnO2,MnO2的一些性质或用途如右图,下列说法正确的是( )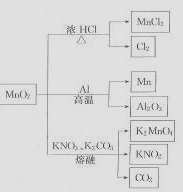
| A.实验室用MnO2与浓盐酸制氯气时,先将MnO2加热至高温再滴入浓盐酸 |
| B.铝置换二氧化锰中锰的反应为吸热反应 |
| C.用石墨电极电解MnSO4溶液,在阳极得到MnO2 |
| D.上述反应中二氧化锰均是氧化剂 |
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2→LiNH2+LiH。下列有关说法正确的是
| A.Li2NH中N的化合价为-1 |
| B.此法储氢和钢瓶储氢的原理相同 |
| C.LiH中的阳离子半径大于阴离子半径 |
| D.该反应中H2既是氧化剂又是还原剂 |
铅蓄电池效率低,污染大,目前正逐步被锌电池取代.锌电池的原料为锌、空气和电解质溶液,电池反应为2Zn+O2=2ZnO,下列关于锌电池的叙述中,正确的是
| A.锌为负极,空气进入负极发生反应 |
| B.正极发生氧化反应,负极发生还原反应 |
| C.负极电极反应是:Zn – 2e- +2OH-=ZnO+H2O |
| D.电池工作时,溶液的pH变小 |
推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”。人们将自来水送检,却是合格的,下列有关说法,合理的是( )
| A.商人电解自来水时,用石墨做阳极;电解净化水时,用铁做阳极 |
| B.电解自来水时,阴极反应式:O2 +2H2O + 4e-= 4OH- |
| C.电解净化水时,a、b两极的pH变化如图2所示 |
| D.电解自来水实验中,若阴极产生气体为3.36L(标况),则阳极质量减小5.6克 |
用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是 ( )
| A.CuSO4 | B.Na2SO4 | C.CuCl2 | D.NaCl |
镍镉(Ni—Cd)充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2  Cd+2NiO(OH)+2H2O 则,该电池放电时的负极材料是( )。
Cd+2NiO(OH)+2H2O 则,该电池放电时的负极材料是( )。
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
目前市场上的手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是铅硫酸二氧化铅。下列关于该铅蓄电池的说法正确的是
| A.充电时电源的正极接铅蓄电池标“+”的一极 |
| B.“无液干粉”铅蓄电池彻底改变了原来的铅蓄电池的原理 |
| C.放电时在铅蓄电池的负极发生还原反应 |
| D.充电时电池上标有“-”的极发生氧化反应 |
一种燃料电池利用在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是
| A.CH3OH(g)+O2(g)==H2O(l)+CO2(g)+2H+(aq)+2e- | B.O2(g)+4H+(aq)+4e-==2H2O(l) |
| C.CH3OH(g)+H2O(l)==CO2(g)+6H+(aq)+6e- | D.O2(g)+2H2O(1)+4e-="=" 4OH- |
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用.锌锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+2H2O+2e-==2MnOOH+2OH- |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-==4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2==2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质是稀硫酸。 ,下列说法正确的是
,下列说法正确的是
| A.铅蓄电池使用一段时间后要添加硫酸 |
| B.电池充电时,阴极反应为:Pb-2e-+SO42- |
| C.电池充电时,电池正极应和电源的正极相连接 |
| D.电池放电时,电池正极周围溶液pH不断增大 |
钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是 ( )
| A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl |
| B.充电时阳极的电极反应为Na++e-===Na |
| C.放电时正极的电极反应为Ni2++2e-===Ni |
| D.该电池被称为绿色电池,最大原因是从废弃电池中可以 |
方便地回收较纯的镍,其他产物对环境没有影响
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中正 确的是 
| A.燃料电池工作时,正极反应为:O2+2H2O+4e一=40H— |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
铅蓄电池的电池反应为:2PbSO4(s)+2H2O Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:
Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:
①放电反应是自发反应,充电反应是电解反应
②反应(1)是充电反应,反应(2)是放电反应
③在充电时,电池中硫酸的浓度不断变小
④在放电时,该电池的负极材料是铅板
⑤在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s)
⑥在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
下列各选项中所包括的说法都正确的是
| A.①③⑤ | B.②④⑥ | C.③⑤⑥ | D.①②④ |