镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+ H2O + 2e-=Cl-+ 2OH-,关于该电池的叙述正确的是
| A.该电池中镁为负极,发生还原反应 |
| B.电池工作时,OH-向正极移动 |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.该电池的总反应为:Mg + ClO-+ H2O=Mg(OH)2↓+ Cl- |
钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求。一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3 +2Na2NiFeII (CN)6 Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是
Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是
| A.放电时NaTi2(PO4)3在正极发生还原反应 |
| B.放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 |
| C.充电过程中阳极反应式为:2NaNiFeIII(CN)6+2Na++2e-=2Na2NiFeII (CN)6 |
| D.该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是
| A.O2在石墨Ⅱ附近发生氧化反应 |
| B.该电池放电时NO3-向石墨Ⅱ电极迁移 |
C.石墨Ⅰ附近发生的反应:3NO2 +2e- NO+ 2NO3- NO+ 2NO3- |
| D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 +Pb+2H2SO4= 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e– = PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。下列说法正确的是:
| A.负极反应为:2H2+4OH- - 4e- = 4H2O |
| B.负极反应为:O2+2H2O+4e-= 4OH- |
| C.电池工作时溶液中的阴离子移向正极移动 |
| D.电池工作时正极区pH升高,负极区pH下降 |
【改编】某原电池装置如图所示,电池总反应为:2Ag+Cl2=2AgCl,下列说法正确的是
| A.负极反应为2Ag-2e-+2Cl-="2AgCl" |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当消耗0.1 mol Ag时,交换膜左右两侧溶液中离子物质的量变化差值为0.2mol |
如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:
LiMnO2 + C6 Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
| A.K与N相接时,A极为负极,该电极反应式为:LixC6 - xeˉ= C6 + xLi+ |
| B.在整个充电或放电过程中都只存在一种形式的能量转化 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.K与M相接时,A极发生氧化反应,LiMnO2 -xeˉ = Li1-xMnO2 + xLi+ |
【改编】二甲醚(CH3OCH3)是一种绿色、可再生的新能源。下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法正确的是
| A.a电极为该电池正极 |
| B.O2在b电极上得电子,被氧化 |
| C.电池工作时,a电极反应式:CH3OCH3—12e-+3H2O = 2CO2↑+12H+ |
| D.电池工作时,燃料电池内部H+从b电极移向a电极 |
2010年4月中旬全球核安全峰会在华盛顿举行,发展核电、制裁核武器发展是会议主题,各式各样电池的发展是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
| A.手机上用的锂离子电池属于一次电池 |
| B.锌锰干电池中,锌电极是负极 |
| C.氢氧燃料电池工作时氢气在负极被还原 |
| D.太阳能电池的主要材料为二氧化硅 |
【改编】下列离子方程式正确的是
| A.将铁和铜用导线连接后同时插入硝酸银溶液中,铜上的电极反应为:Cu-2e-=Cu2+ |
| B.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+= 2Fe3++2Cl- |
| C.将金属钠放入硫酸铜溶液中:2Na+Cu2+-=2Na++Cu |
| D.酸性氢氧燃料电池的正极反应:H2-2e-= 2H+ |
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO32- |
电化学降解NO3-的原理如图所示。下列说法中正确的是
| A.铅蓄电池的A极为负极,电极材料为Pb |
| B.铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4 |
| C.该电解池的阴极反应为2NO3- + 12H++ 10e- = N2↑ + 6H2O |
| D.若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(Δm左—Δm右)为14.4g |
特斯拉全电动汽车使用的是钴酸锂电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式 。下列说法不正确的是
。下列说法不正确的是
| A.放电时电子从A极通过导线流向B极 |
| B.放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ |
| C.充电时Li+从左边流向右边 |
D.充电时B作阳极,电极反应式为: |
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是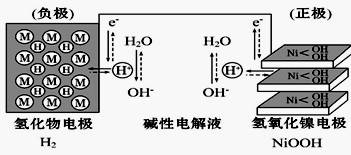
| A.放电时电池内部H+向负极移动 |
| B.充电时,将电池的负极与外接电源的正极相连 |
| C.充电时阳极反应为Ni(OH)2+ OH-- e-====NiOOH+H2O |
| D.放电时负极的电极反应式为MHn-ne-= M+nH+ |