银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;
Ag2O+H2O+2e- = 2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
| A.锌为正极,Ag2O为负极 | B.锌为负极,Ag2O为正极 |
| C.原电池工作时,正极区PH减小 | D.原电池工作时,负极区PH增大 |
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是 ( )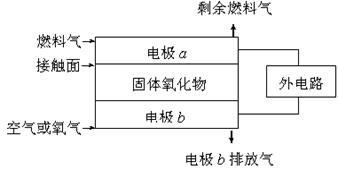
A.电极b为电池负极,电极反应式为O2+4e-=4O2-[
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e- + H2O = CH3COOH + 4H+。下列有关说法正确的是( )
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e- + 2H2O = 4OH- |
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2+M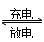 NiOOH+MH,下列叙述正确的是
NiOOH+MH,下列叙述正确的是
| A.放电时正极附近溶液的碱性增强 |
| B.放电时负极反应为:M+H2O+e-===MH+OH- |
| C.放电时阳极反应为:NiOOH+H2O+e-===Ni(OH)2+OH- |
| D.放电时每转移1 mol电子,正极有1 mol NiOOH被氧化 |
一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2+4OH- 2CO32-+6H2O,则下列说法正确的是
2CO32-+6H2O,则下列说法正确的是
| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阴极 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32-+6H2O |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
其电池反应为:2CH3OH + 3O2 + 4OH—  2CO32— + 6H2O,则下列说法错误的是
2CO32— + 6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
镍镉(NiCd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
美国科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50 W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电路中每通过5 mol电子,在标准状况下约有5.6 L丙烷被完全氧化 |
| C.通丙烷的电极为电池负极,该极发生的电极反应式为C3H8-20e-+10O2-===3CO2+4H2O |
| D.丙烷燃料电池的能量利用率比丙烷燃烧的能量利用率大 |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e—="=" Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷(C2H6)和氧气,其电极反应式为:C2H6+18OH——14e-=2CO32—+12H2O,2H2O+O2+4e-=4OH—,有关此电池的推断不正确的是 ( )
| A.正极发生还原反应 | B.正极与负极上参加反应的气体的物质的量之比为2∶9 |
| C.通乙烷的电极为负极 | D.电池工作过程中,溶液的pH逐渐减小 |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O,2H2O+O2+4e-=4OH-,有关此电池的推断正确的是( )
| A.电池工作过程中,溶液的pH值逐渐减小 |
| B.正极与负极上参加反应的气体的物质的量之比为2:7 |
| C.通乙烷的电极为正极 |
| D.正极发生氧化反应 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
一种新型燃料电池,一极通入空气,另一极通入甲烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
| B.在外电路,电流从甲烷所通电极流向空气所通电极 |
| C.通入空气的一极是正极,电极反应为:O2-4e-=2O2- |
| D.通入甲烷的一极是负极,电极反应为: CH4-8e-+4O2-=CO2+2H2O |
可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
| A.NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
| B.NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |