[吉林]2011-2012学年吉林长春市十一高高一下学期期中考试化学试卷
下列对化学反应的认识错误的是( )
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |
下列有关叙述正确的是( )
A.硫原子的原子结构示意图: |
B.过氧化钠的电子式:Na+[ 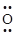  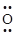  ]2- Na+ ]2- Na+ |
C.原子核内有8个质子、10个中子的氧原子: |
D. 和 和 互为同位素 互为同位素 |
下列说法正确的是( )
| A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同 |
| B.粗铜精炼时,与电源负极相连的是粗铜 |
| C.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 |
下列说法正确的是( )
| A.当∆H﹤0时,表示该反应为吸热反应 |
B.相同条件下,溶液中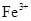 、 、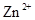 、 、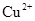 的氧化性依次减弱 的氧化性依次减弱 |
| C.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D.钢铁吸氧腐蚀的正极电极反应:O2+2H2O+4e-==4OH- |
下列说法正确的是( )
| A.对于有气体参加的化学反应来说,增大压强,可使活化分子百分数增多,化学反应速率一定增大 |
| B.升高温度,活化分子百分数不变,但是碰撞的频率增大,所以化学反应速率增大 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| D.加入正催化剂,可以降低该反应的活化能,会使反应物活化分子百分数增加,所以化学反应速率加快 |
反应4A(s) + 3B(g) =" 2C(g)" + D(g),经2min,B的浓度减少0.6mol·L-1,对此反应速率的表示,正确的是( )
A.用A表示的反应速率为0.4mol·L-1·min-1
B.分别用B、C、D表示的反应速率其比值为3:2:1
C.用B表示的反应速率为0.3mol·L-1·s-1
D.用C表示的反应速率为0.6mol·L-1·s-1
下图中每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )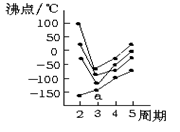
| A.H2S | B.HCl | C.SiH4 | D.PH3 |
已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A.质子数c>b | B.离子的还原性Y2->Z- |
| C.氢化物的热稳定性H2Y>HZ | D.原子半径X<W |
X、Y、Z、W均为短周期元素,在周期表中位置如图所示。Y原子的最外层电子数是电子层数的3倍。下列说法中不正确的是( )
| A.Y、Z的气态氢化物,前者更稳定 |
| B.Z、W的最高价氧化物对应水化物的酸性,前者强 |
| C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键 |
| D.Y、W的单质,均可通过电解的方法获得 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
下图中,两电极上发生的电极反应如下:a极:2H+ + 2e— =H2↑,b极:Fe-2e— =Fe2+,则以下说法不正确的是( )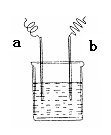
| A.该装置可能是电解池 |
| B.溶液pH变大 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
恒温恒容条件下,能使

 正反应速率加快的是( )
正反应速率加快的是( )
| A.减少C或D的物质的量 | B.体积不变充入氦气使压强增大 |
| C.减少B的物质的量 | D.增大A或B的物质的量 |
下列说法不正确的是( )
| A. |
B. |
C. |
D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 |
甲电极上的电极反应为:2Cl--2e- = Cl2↑ |
Pt电极上的电极反应为:O2+2H2O+4e-==4OH- |
总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
 |
 |
 |
 |
下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
| A.①③⑤ | B.②④⑥ | C.②③④ | D.①③⑥ |
核内中子数为N的R2+ 离子,质量数为A,则ng该氧化物中所含电子的物质的量( )
A. |
B. |
| C.(A−N+2)mol | D.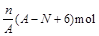 |
下列有关热化学方程式的表示及说法正确的是( )
| A.已知c(石墨,s)=c(金刚石,s)△H>0,则金刚石比石墨稳定 |
| B.已知I2(g)+H2(g)=2HI(g)△H1;I2(s)+H2(g)=2HI(g)△H2;则△H1<△H2 |
| C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.已知H2(g)+F2(g)=2HF(g)△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量 |
在20℃时某化学反应的速率为0.15 mol•L-1•s-1,若温度每升高5℃,反应速率提高到原来的2倍,则为使反应速率达到1.2 mol•L-1•s-1,应使反应在什么温度下进行( )
| A.30℃ | B.35℃ | C.40℃ | D.45℃ |
下列相关实验不能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A. |
把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 |
验证接触面积对化学反应速率的影响。 |
| B. |
在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中。观察气泡快慢; |
验证温度对化学反应速率的影响。 |
| C. |
常温下,直接将表面积相同的铝条和镁条投入同浓度同体积的稀盐酸中,观察产生气泡的速率。 |
比较同周期金属元素的金属性强弱。 |
| D. |
将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中,观察气泡。 |
比较金属活泼性强弱 |
燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池的能量利用率可高达80%,产物污染也少。下列有关燃料电池说法错误的是( )
| A.氨气燃料电池的电解质常用KOH溶液,其负极电极反应为:2NH3-6e-+6OH-=N2+6H2O |
| B.碱性甲烷燃料电池的正极反应为:O2+2H2O+4e-=4OH- |
| C.燃料电池负极燃料失电子,发生还原反应 |
| D.除纯氧外,空气中的氧气也可以作氧化剂 |
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、—2 |
—2 |
A.氢化物的沸点为H2T<H2R B.M与T形成的化合物具有两性
C.单质与稀盐酸反应的速率为L<Q D.L2+与R2-的核外电子数相等
等质量的锌与过量的盐酸在不同条件下进行反应,测定在不同时间t产生氢气的体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的试验组别可能是( )
| A.③①②④ | B.③①④② | C.②④③① | D.③④②① |
在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g) =CO(g) ΔH1=-110.5 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(g) ΔH2=-241.7 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
下列说法正确的是( )
| A.C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.2 kJ·mol-1 |
| B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O (l)ΔH=-571.6 kJ·mol-1 |
| C.2H2O(g)=2H2(g)+O2 (g)ΔH=-483.4 kJ·mol-1 |
| D.H2O(g)=H2O(l)ΔH=-44.1 kJ·mol-1 |
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素X与氢形成的原子个数比为1:4的化合物中只含有极性共价键 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法正确的是( )
| A.a电极是阴极 |
| B.a极区的KI最终转变为KIO3 |
| C.阳极电极反应:4OH—-4e— =2H2O+O2↑ |
| D.电解过程中OH—从a极区通过离子交换膜c进入b极区 |
在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4混合均匀.取一定量溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的质量之比为( )
| A.35.5∶108 | B.1∶2 | C.108∶35.5 | D.8∶1 |
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
(1)图中所示反应是_____________(填“吸热”或“放热”)反应,该反应的△H=____________ kJ·mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1。该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为 kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是 。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
① Y电极上的电极反应式为 。
在X极附近观察到的现象是 。
②电解总反应离子方程式为 。
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
① Y电极的材料是 (选填纯铁、纯铜或纯锌),电极反应式是 。电解液a选用 溶液,电解过程中其浓度 (选填增大、减小或不变)。
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:
。
“碘钟”实验中,3I-+S2O82-=I3-+ 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号