人造地球卫星用到一种高能电池—银锌蓄电池,它在放电时的电极反应为:
Zn+2OH--2e-==ZnO+H2O Ag2O+H2O+2e-==2Ag+2OH- 据此判断氧化银是( )
| A.负极,被氧化 | B.正极,被还原 | C.负极,被还原 | D.正极,被氧化 |
将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
| A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O |
| D.甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH- |
铅蓄电池的工作原理为Pb+PbO2+2H2SO4====2PbSO4+2H2O,研读下图,下列判断不正确的
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-====PbO2+4H++ |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
C.K闭合时,Ⅱ中 向c电极迁移 向c电极迁移 |
| D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是
| A.在熔融电解质中,O2—由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2→ 8CO32―+ 10H2O |
C.通入空气的一极是 正极,电极反应为:O2 + 4e— = 2O2— 正极,电极反应为:O2 + 4e— = 2O2— |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e— + 13O2—═ 4CO2+ 5H2O |
铅蓄电池总反应为PbO2+Pb+2H2SO4═2PbSO4+2H2O,下列关于铅蓄电池的说法正确的是
| A.在放电时,正极发生的反应是 Pb(s) +SO42―(aq)= PbSO4(s) +2e― |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是 PbSO4(s)+2e―=" Pb(s)+" SO42―(aq) |
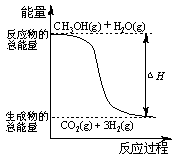
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |
大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车专项中一项重要课题。我国镍氢电池居世界先进水平,解放军潜艇将装备国产大功率镍氢功力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价为零),电池反应通常表示为:
下列有关镍氢电池的说法,不正确的是( )
| A.电池工作时,储氢合金作负极 |
| B.电池充电时,阳极发生氧化反应 |
| C.电池放电时,电子由正极通过外电路流向负极 |
| D.电池工作时,负极反应式:LaNi5H6—6 e—+60H—==LaNi5+6H2O |
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水(l)和二氧化碳。该电池负极发生的反应是( )
| A.CH3OH(g)+O2(g)-2e-=H2O(l)+CO2(g)+2H+(aq) |
| B.O2(g)+4H+(aq)+4e-=2H2O(l) |
| C.CH3OH(g)+H2O(l)-6e-=CO2(g)+6H+(aq) |
| D.O2(g)+2H2O(l)+4e-=4OH-(aq) |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)
3Zn(OH) 2+2Fe(OH)3+4KOH(从左到右放电,从右到左充电)。下列叙述不正确的是 ( )
2+2Fe(OH)3+4KOH(从左到右放电,从右到左充电)。下列叙述不正确的是 ( )
| A.放电时锌做负极 | B.充电时氢氧化铁被氧化 |
| C.充电时电池的正极和电源的正极相连 | D.放电时每转移3mole-,有2molFeO42-被还原 |
有一种纽扣微型电池,其电极分别是Ag2O和Zn。电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2OH-+2e=Zn(OH)2,Ag2O+H2O+2e=2Ag+OH-下列说法,正确的是①锌为负极,Ag2O为正极②放电时,正极附近pH值上升③放电时,负极附近溶液pH值降低④溶液中阴离子向正极方向移动,阳离子向负极方向移动
| A.① | B.①②④ | C.①②③ | D.①②③④ |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为: 2Li++FeS+2e-=Li2S+Fe 有关该电池的下列叙述中,正确的是
A.Li -Al在电池中作为负极材料,该材料中Li的化合价为+1价 -Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为:2Li+FeS=Li2S+Fe |
| C.负极的电极反应式为Al-3e-=Al3+ |
D.充电时,阴极发生的电极反应式为: |
锌锰干电池在放电时电池总反应方程式可以表示为:Zn+2MnO2+2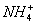
 Zn2++Mn2O3+2NH3+H2O,在此电池放电时,正极(碳棒)上发生反应的物质是( )
Zn2++Mn2O3+2NH3+H2O,在此电池放电时,正极(碳棒)上发生反应的物质是( )
A.MnO2和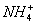 |
B.Zn2+和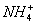 |
C.Zn | D.碳棒 |
下列有关化学电池的说法不正确的是( )
| A.化学电池是将化学能变成电能的装置 |
| B.一次电池的活性物质消耗到一定程度就不能使用了 |
| C.二次电池又称充电电池或蓄电池,放电后可以再充电,故可多次重复使用 |
| D.燃料电池是将燃料燃烧所放出的能量转化为化学能装置 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾为电解质,电池总反应式为Zn(s) + 2MnO2(s) + H2O(l) = Zn(OH)2(s) +Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。 甲
甲 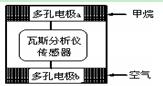 乙
乙
下列有关叙述正确的的是( )
| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4+5O2—―8e-=CO32- +2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |