推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”。人们将自来水送检,却是合格的,下列有关说法,合理的是( )
| A.商人电解自来水时,用石墨做阳极;电解净化水时,用铁做阳极 |
| B.电解自来水时,阴极反应式:O2 +2H2O + 4e-= 4OH- |
| C.电解净化水时,a、b两极的pH变化如图2所示 |
| D.电解自来水实验中,若阴极产生气体为3.36L(标况),则阳极质量减小5.6克 |
目前市场上的手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是铅硫酸二氧化铅。下列关于该铅蓄电池的说法正确的是
| A.充电时电源的正极接铅蓄电池标“+”的一极 |
| B.“无液干粉”铅蓄电池彻底改变了原来的铅蓄电池的原理 |
| C.放电时在铅蓄电池的负极发生还原反应 |
| D.充电时电池上标有“-”的极发生氧化反应 |
铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质是稀硫酸。 ,下列说法正确的是
,下列说法正确的是
| A.铅蓄电池使用一段时间后要添加硫酸 |
| B.电池充电时,阴极反应为:Pb-2e-+SO42- |
| C.电池充电时,电池正极应和电源的正极相连接 |
| D.电池放电时,电池正极周围溶液pH不断增大 |
铅蓄电池的电池反应为:2PbSO4(s)+2H2O Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:
Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:
①放电反应是自发反应,充电反应是电解反应
②反应(1)是充电反应,反应(2)是放电反应
③在充电时,电池中硫酸的浓度不断变小
④在放电时,该电池的负极材料是铅板
⑤在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s)
⑥在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
下列各选项中所包括的说法都正确的是
| A.①③⑤ | B.②④⑥ | C.③⑤⑥ | D.①②④ |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: Cd(OH)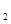 +2Ni(0H)
+2Ni(0H)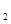
 Cd+2NiOOH+2H
Cd+2NiOOH+2H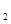 O。由此可知,该电池充电时在阴极 上发生反应的是 ( )
O。由此可知,该电池充电时在阴极 上发生反应的是 ( )
A.Cd(OH)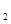 |
B.Ni(OH)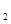 |
C.Cd | D.NiOOH |
目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx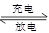 2Na+xS,以下说法正确的是)
2Na+xS,以下说法正确的是)
| A.放电时,Na 作正极,S极发生还原反应 |
| B.充电时,阳极发生的反应为:Sx2--2e-=xS |
| C.当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠23g |
| D.充电时钠极与外电源的正极相连 |
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
V3++ VO2++H2O VO2++2H++V2+ 下列说法正确的是
VO2++2H++V2+ 下列说法正确的是
| A.放电时正极反应为:VO+2+2H++e—=VO2+ +H2O |
| B.放电时每转移2mol电子时,消耗1mol氧化剂 |
| C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 |
| D.放电过程中,H+由正极移向负极 |
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
下列叙述不正确的是
| A.该电池放电时的正极和充电时的阴极均发生还原反应 |
| B.放电时负极反应为:MH+OH——e— = M+H2O |
| C.充电时阳极反应为:NiOOH+H2O+e— = Ni(OH)2+OH— |
| D.放电时每转移1mol电子,正极有1molNiOOH被还原 |
铁镍蓄电池放电时的总反应为:Fe+Ni2O3+3 H2O  Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液 |
| B.电池的正极为Ni2O3、负极为Fe |
C.电池放电时,负极反应为Fe+20H一一2e一  Fe(OH)2 Fe(OH)2 |
| D.电池充电时,阳极附近溶液的pH升高 |
一种充电电池放电时的电极反应为
H2+2OH--2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当 为电池充电时,与外电源正极连接的电极上发生的反应是
为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 |
| C.H2的氧化 | D.Ni(OH) 2的氧化 |
铅蓄电池的示意图如图所示。下列说法正确的是
| A.放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-=PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42- |
| D.充电时,若N连电源正极,则该极生成PbO2 |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为: 5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl ,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl——e—=AgCl | B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
新型微生物原料电池可以将富含有机物的污水变成干净的水,同时提供电能。该电池中用质子交换膜将正负极分开。工作时,将污水注入反应槽中,污水中的有机物在微生物作用下分解放出电子和质子,质子通过交换膜到另一极与富含氧气的水反应。下列说法正确的是
| A.注入污水的一极是电池的负极,发生氧化反应 |
| B.注入污水的一极是电池的正极,发生氧化反应 |
| C.这种新型微生物燃料电池适宜处理硫酸厂的废水 |
| D.用葡萄糖表示污水中的有机物,通入污水一极的电极反应为 |
C6H12O6+6O2 6CO2+6H2O
6CO2+6H2O
一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为: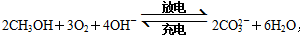 ,则有关说法正确的是
,则有关说法正确的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH-→CO+6H2O+6e- |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |