某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、
SO42-,现每次取该溶液100.00ml溶液进行以下实验:
①第一份加入AgNO3溶液发现有沉淀生成;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗
涤干燥得沉淀2.33g.
请回答下列问题:
(1)根据以上实验判断,原溶液中一定不存在的离子是 ,可能存在的离子是 。
(2)原溶液中一定存在的阳离子是 ,其物质的量浓度至少为 mol/l.
(3)原溶液中一定存在的阴离子是 ,其物质的量浓度分别为 mol/L、 mol/l.。
完成下列反应的离子方程式
(1)Ba(OH)2溶液加入过量NaHCO3溶液_____。
(2)NaClO溶液中通入少量CO2_____。
(3)将Fe(NO3)3溶液与过量HI混合_____。
(4)向FeBr2中通入等量Cl2_____。
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸溶液反应
②碳酸钙和足量稀盐酸反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Zn+2H+==Zn2++H2↑
②HCO3-+ H+==CO2↑+ H2O
(9分)(1)向某溶液中加入KSCN溶液无明显现象,再滴入数滴氯水后,溶液立即变成红色,则原溶液中一定含有________离子,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是________(填字母)。
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 。
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 。
(3)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是________(填字母)。
A.铜粉 B.氯气 C.铁粉 D.KSCN溶液
(4)向沸水中逐滴滴加1 mol·L-1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是____nm,区别该液体和FeCl3溶液可用 方法。
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________(填写物质序号)。
(3)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(4)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
(1)写出H2O2的电子式 。
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是 。
(3)将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为 ,反应中H2O2作 剂。
(4)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里: MnO4﹣+ H2O2+ H+═ Mn2++ H2O+ 。
阅读下列材料后回答问题:一个体重50Kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+ Fe3+的转化时,实现①的转化需消耗 剂(填氧化或还原),
Fe3+的转化时,实现①的转化需消耗 剂(填氧化或还原),
通常用 (填试剂名称)检验Fe3+存在。
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作 剂,Fe3+发生 反应。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为 。
将1mol/L的FeCl3溶液逐滴滴入沸水中,液体变为 色,得到的是 ;反应的化学方为 。向其中逐滴加入稀硫酸至过量,现象是 ,原因是 。
某无色透明溶液与金属铝反应放出氢气。下列离子:Mg2+、Cu2+、 Ba2+、H+、 Ag+、SO42-、HCO3- 、OH-。判断何者能大量存在于此溶液中:
(1)当生成Al3+时,一定大量存在 ,可能存在 ,一定不存在
(2)当生成AlO2-时,一定大量存在 ,生成氢气的离子方程式是
(10分)下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图像的序号填入表中。

| 溶液 |
加入的物质 |
答案序号 |
| ①饱和石灰水 |
通过量CO2 |
|
| ②AlCl3溶液 |
通过量NH3 |
|
| ③MgCl2、AlCl3混合溶液 |
逐滴加NaOH溶液至过量 |
|
| ④AlCl3溶液 |
逐滴加NaOH溶液至过量 |
|
| ⑤含少量HCl的AlCl3溶液 |
逐滴加NaOH溶液至过量 |
|
根据下列变化进行推断: 
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
写出铝、氧化铝分别与盐酸反应的离子方程式:
, ,
根据所学知识,完成下列要求。
(1)Fe2(SO4)3(写出电离方程式): 。
(2)H++OH-═ H2O(写出对应的化学方程式): 。
(3)氧化铜溶于盐酸(写出对应的离子反应方程式): 。
(4)锌与稀硫酸反应制取氢气(写出对应的离子反应方程式): 。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~6.8 |
| Ca2+、Mg2+总浓度 |
<0.0045mol/L |
| 细菌总数 |
<100个/L |
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池 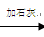 一级沉降池
一级沉降池 二级沉降池
二级沉降池 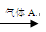 过滤池→自来水
过滤池→自来水
(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式 。
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。这种作用是基于气体A和水反应的产物
具有 性.
(5)下列物质中, 可以作为气体A的代用品。(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3 (液) ③K2FeO4 ④SO2