钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
写出下列过程的离子方程式。
⑴除去铁粉中混有的铝粉
⑵除去CO2中混有的HCl
⑶NaAlO2溶液中通入少量CO2
⑷1 mol/L 100 mL FeBr2溶液中通入2.24 L Cl2(标准状况)
由氯化铁溶液制备胶体的化学方程式为_______________________________.
反应物间进行微粒交换是化学反应的特征之一,置换反应、复分解反应、取代反应都属于反应物间进行微粒交换的化学反应。
(1)NaHCO3和NaOH的反应是NaHCO3电离的H+离子和NaOH电离出的 离子相互交换的反应。
(2)在浓硫酸作用下,羧酸与醇也是微粒交换的反应,请写出乙酸和乙醇反应的化学方程式: 。
(3)工业上利用铝热反应用铝粉和MnO2冶炼金属锰,写出化学方程式: 。
(4)工业上制取粗硅的反应也是一个置换反应,此反应的反应物中含有三种元素,这三种元素的非金属性由强到弱的顺序为 。与硅同周期的某元素,其最高价氧化物既可溶于强酸又可溶于强碱,请写出该氧化物溶于强碱的离子方程式: 。
(5)NH3和Cl2发生置换反应,当NH3过量时,NH3继续与HCl反应。当有3molCl2参与反应时,有
molNH3被氧化。
(6)(NH4)2CO3和H2CO3的反应也进行微粒交换,当往(NH4)2CO3溶液中通入一定量CO2至溶液呈中性时,溶液中HCO3-和NH4+的比值 (填“大于”“小于”或“等于”)1:1。
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④X的最外层电子数是其电子层数的2倍;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)Z元素在元素周期表中的位置为_________,化合物WY的电子式为_______________________________。
(2)实验室用 WX2与饱和食盐水来制某种气态有机化合物,反应的化学方程式为
___________________________________________________________________________。
(3)Cu2Z与过量浓硝酸反应有红棕色气体生成,反应的离子方程式为
______________________________________________________________________________。
现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡。根据要求回答下列问题:
(1)下图为常见物质的树状分类图:
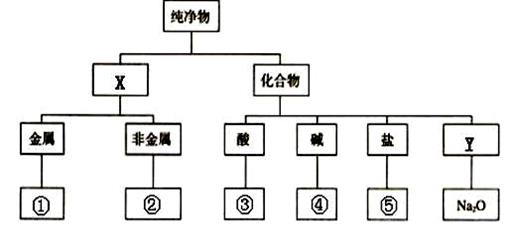
X属于_________(填物质类属);若图中①—⑤分别代表上述五种物质,则④对应的化学式是 。
(2)上述五种物质中,有一种物质能与其他三种物质发生反应。该物质是__________。
(3)上述五种物质间发生置换反应的离子方程式____________________
(4)写出过量的③与④反应的离子方程式 ____________________
在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如下图所示,则:

(1)“O”点导电能力为0的理由是_________________________。
(2)用湿润的pH试纸测量a处溶液的pH,测量结果_________(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①pH:__________ ;
②醋酸的电离度:_________ ;
③醋酸的电离平衡常数:__________ ;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:___________。
(4)若使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施有(答二类不同的物质):
①___________________②_____________________。
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是 。
| A.c(H+) | B.H+个数 | C.CH3COOH个数 | D.c(H+)/c(CH3COOH) |
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子方程式表示)________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是___________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是__________________________(请用反应的离子方程式表示)。
(4)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
(a)在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(b)NaA溶液显________(填“酸性”、“中性”或“碱性”),
写出与下列每一个离子方程式对应的一个化学反应方程式:
(1)CO32-+2H+=H2O+CO2↑: 。
(2)H++OH-=H2O: 。
(3)Mg+2H+=Mg2++H2↑: 。
(4)BaCO3+2H+=Ba2++H2O+CO2↑: 。
将铁投入到稀硝酸溶液中,会发生如下反应:
Fe + 4HNO3(稀) = Fe (NO3)3 + NO↑ + 2H2O
(1)用双线桥法标出电子转移的方向和数目
(2)已知反应过程中消耗了28g铁,则转移电子的物质的量为 ,被还原的硝酸的物质的量为 。
(3)请将以上反应改写为离子方程式 。
写出下列反应的离子方程式
(1)铝与氢氧化钾浓溶液反应
(2)向偏铝酸钠溶液中通过量二氧化碳
(3)向NaHSO4溶液中加入Ba(OH)2使溶液呈中性
(4)过氧化钠与稀食盐水反应
(5)碳酸氢钙与过量氢氧化钠反应
(6)向硝酸亚铁溶液中滴加盐酸
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NAOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NAOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=A |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中C(A-)和C(NA+)的大小关系是
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
C(NA+)-C(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的NA2B溶液中,下列粒子浓度关系式正确的是________。
A.C(B2-)+C(HB-)=0.1 mol/L
B.C(B2-)+C(HB-)+C(H2B)=0.1 mol/L
C.C(OH-)=C(H+)+C(HB-)
D.C(NA+)+C(OH-)=C(H+)+C(HB-)
(III)已知:25 ℃时,Ksp(BASO4)=1×10-10,Ksp(BACO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BASO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BASO4仍然是安全的,BASO4不溶于酸的原因是(用溶解平衡原理解释)___________________________。
万一误服了少量BACO3,应尽快用大量0.5 mol/L NA2SO4溶液给患者洗胃,如果忽略洗胃过程中NA2SO4溶液浓度的变化,残留在胃液中的BA2+浓度仅为_____mol/L。
按要求作答:
(1)石灰石与稀硝酸反应的离子方程式:_____________________________
(2)硫酸铜溶液与氢氧化钾溶液反应的离子方程式:_____________________
(3)写出HCl只做氧化剂的反应化学方程式:______________________________
(4)写出碳单质做还原剂的反应化学方程式:________________________________
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
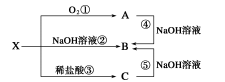
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④