Ⅰ、按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式) 。
(2)氯化铁溶液中通入二氧化硫气体(离子方程式) 。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式) 。
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式) 。
Ⅱ、已知Fe2O3在高炉中有下列反应:Fe2O3+CO=2FeO+CO2,反应形成的固体混合物(Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)可能是 。
a.7:5 b.3:1 c.7:1
(2)设Fe2O3被CO还原的百分率为A%,则用含m(Fe)、m(O)的代数式表示A%的关系式为 。
某溶液中含有X-、Y2-、Z2-三种常见的无机离子。如下图所示,发生了一系列化学反应。第④步反应生成的白色沉淀中含Y2-.

|
(6分)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O72-废水的方法如下:
(1)向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余的Cr3+的物质的量浓度为 mol·L-1(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2 S2O3标准溶液,终点时消耗Na2 S2O3溶液20.00 ml。计算废水中铬元素总浓度 mg·L-l
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答:
(1)AB段所表示的反应的离子方程式是 ;
CD段所表示的反应的离子方程式是 。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是 。
(3)a是______________,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)= _____________________
_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
试通过计算确定400℃剩余固体成分的化学式 。(写出计算过程)
含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。
回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
| A.S2- | B.S | C.SO32- | D.SO42- |
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。
所选试剂是____________,该反应的离子方程式为: 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,最佳途径是__________(填序号),理由是 。
铁、铝、铜都是中学化学常见的金属.
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为: 。
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为: 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 。
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,
4Fe+10HNO3="4" Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是 ,第二个反应每生成1molNH4NO3,被还原的硝酸的物质的量是 。
③如何检验NH4NO3溶液中的NH4+离子,请描述操作 ,写出相关的离子反应方程式 。
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入 。
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母) 。
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
(12分)A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素F在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________。
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有______。检验该化合物中的阳离子的方法是________(用离子方程式表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:________________________。若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________。
(14分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为_____。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为____________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4─空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________;负极的电极反应式为 。
将镁、铝的混合物共0.2 mol,溶于200mL 4mol/L的盐酸溶液中,然后再滴加2 mol/L 的NaOH溶液。请回答下列问题:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Al)= mol;
(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)= mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol/L的硫酸溶解此混合物后,再加入840mL 2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。则a的取值范围为 。
I.(1)鉴别KCl溶液和K2CO3的试剂是 ,除去SO2中的HCl的试剂是 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法。分离碘和CCl4的操作方法 。
(3)除去混入Fe2O3中少量SiO2杂质的试剂是 ,离子方程式为 。
II.氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(4)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________。(填“氧化性”或“还原性”)
(5)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收,服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中维生素C所起的作用是 。(填“氧化剂”或“还原剂”)
(6)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________。
| A.若管道漏气遇NH3就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
在氮单质和常见化合物中:
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是 。原因是 。
(2)常用作制冷剂的物质是 ,原因是 。
(3)能与酸反应生成盐、在常温下为气态的物质是 写出它与HCl等强酸反应的离子方程式: 。
(4)在通常状况下是晶体、易溶于水、可以作氮肥、遇碱会放出带刺激性气味气体的物质是 ,写出它们与NaOH等强碱溶液反应的离子方程式: 。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的3倍。
| 甲 |
乙 |
|
| |
丙 |
丁 |
请用化学用语回答:
(1)丙在元素周期表中的位置是 。
(2)丁单质的电子式是 。
(3)乙的两种常见单质分别是 、 。
(4)甲、乙、丙、丁的气态氢化物水溶液显酸性的是 、___________。
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是____________ (填化学式)。此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
(6)电解丙的饱和钠盐溶液的离子方程式为 。
(7)若甲的元素符号为X。已知:①X2(g)+2O2(g)===X2O4(l) ΔH=-19.5 kJ·mol-1;
②X2H4(l)+O2(g)===X2(g)+2H2O(g)ΔH=-534.2 kJ·mol-1。
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化学方程式为 。
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题: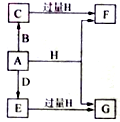
(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的化学方程式为 。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为 。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。

(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。