(21分)过氧化氢常用作氧化剂、漂白剂和消毒剂,可用于甲型H1N1流感消毒,为了贮存运输和使用的方便,工业上采用“醇析法”,将它转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和Na2O2的双重性质,工业“醇析法”的工艺如下:

回答下列问题:
(1)过氧化氢溶液加入二氧化锰的反应化学方程式为_____________。
(2)反应温度控制在0~5 ℃时进行的理由是___________。
(3)稳定剂能相互反应,生成一种不溶物将过碳酸钠粒子包住,该反应的化学方程式为_________。
(4)加入异丙醇的作用是___________。
(5)下列物质不能使过碳酸钠较快失效的是________。
a.FeCl3 b.Na2S c.CH3COOH d.NaHCO3
(6)根据题中有关信息,请你提出贮存、运输过碳酸钠晶体中应注意(至少两项):___________。
(7)某同学向酸性高锰酸钾溶液中滴入过量过氧化氢溶液,观察到高锰酸钾溶液褪色,则发生反应的离子方程式为__________。
X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子的3d轨道为半充满状态,新制备的R的氢氧化物悬浊液可用于检验醛基的存在。请回答下列问题:
(1)X2分子中σ键和π键数目比是 ;
(2)R的晶胞结构如图所示,该晶胞中所含的原子个数是 ;

(3)下列有关X、Y、W的说法正确的是 ;
①第一电离能的排序是Y>X>W
②常温下,Y的氢化物分子间存在氢键
③XY3一中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(4)X的气态氢化物分子的空间构型为 ,将其水溶液滴入R的氢氧化物悬浊液中,反应的离子方程式为 ;
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 。
粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如下图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。
(2)滤渣B的主要成分与NaOH溶液反应的离子方程式为________。
(3)步骤③中用NH4HCO3调节pH的实验原理为__________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、_________,得到的晶体主要成份是_________(填化学式)。第⑥步生成Al(OH)3的离子方程式为_________。
查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。
试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2 B.Fe C.H2O2 D.HNO3
(3)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:_________________。
(4)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是____________。
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)湿法制备高铁酸钠(Na 2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO—、OH-、FeO42—、Cl—、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式: 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是 。
(2)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na 2FeO4+2 Na 2O+2 Na 2SO4+O2↑
该反应中的还原剂是 ,氧化产物是 ,每生成l mol Na 2FeO4转移 mol电子。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:___ FeO42-+___ H2O="___" Fe(OH)3(胶体)+_____O2↑+___OH-。
【化学—选修2化学与技术】某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是__________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________。
(3)②中反应后无气体放出,该反应的离子方程式为___________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因______________________。
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + ↑
Cu AlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为______mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。

(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
(1)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式: 。
(2)在海水提溴过程中,吸收塔中用SO2和H2O将Br2转化成氢溴酸以达到富集的目的,请写出化学方程式: 。
(3)(NH4)2Fe(SO4)2属于盐类,溶于水后会电离出NH4+和Fe2+,写出检验的操作和现象:
a:检验Fe2+:取少量样品于试管中, ;
b:检验NH4+ :取适量样品于试管中, 。
氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路。燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的。
(1)在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量。写出该反应的热化学方程式 ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.0kJ·mol-1。若将1mol甲烷与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH= ;
(3)欲制得较纯净的氢气,可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式 ;
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题: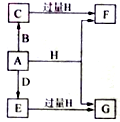
(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的化学方程式为 。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为 。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的3倍。
| 甲 |
乙 |
|
| |
丙 |
丁 |
请用化学用语回答:
(1)丙在元素周期表中的位置是 。
(2)丁单质的电子式是 。
(3)乙的两种常见单质分别是 、 。
(4)甲、乙、丙、丁的气态氢化物水溶液显酸性的是 、___________。
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是____________ (填化学式)。此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
(6)电解丙的饱和钠盐溶液的离子方程式为 。
(7)若甲的元素符号为X。已知:①X2(g)+2O2(g)===X2O4(l) ΔH=-19.5 kJ·mol-1;
②X2H4(l)+O2(g)===X2(g)+2H2O(g)ΔH=-534.2 kJ·mol-1。
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化学方程式为 。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .