NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2•12H2O,其工艺流程图如下
(1)流程图中X的电子式 , Y为 (填化学式)溶液
(2)反应Ⅱ的离子方程式为
(3)流程中可以循环使用的物质的名称是
(4)反应Ⅵ的化学方程式为
(5)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是 。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(6)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为____。
(7)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: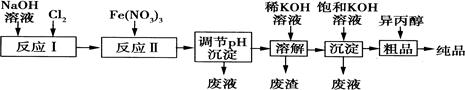
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—) |
| C.溶液的颜色不变 | D.溶液的pH值不变 |
(3)写出第②步中Cr2O72-转变为Cr3+的离子方程式: 。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为 ,溶液中离子浓度由大到小的顺序为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有, ,可能含有 。
(2)写出上述实验中一定发生的有关反应的离子反应方程式: 。
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH) 2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH) 2的Ksp=2.2×10-20)。
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-。该反应的离子方程式为______________。
Ⅰ、按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式) 。
(2)氯化铁溶液中通入二氧化硫气体(离子方程式) 。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式) 。
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式) 。
Ⅱ、已知Fe2O3在高炉中有下列反应:Fe2O3+CO=2FeO+CO2,反应形成的固体混合物(Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)可能是 。
a.7:5 b.3:1 c.7:1
(2)设Fe2O3被CO还原的百分率为A%,则用含m(Fe)、m(O)的代数式表示A%的关系式为 。
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
1.00 |
0 |
0 |
||
| 10 |
0.58 |
0.21 |
0.21 |
||
| 20 |
0.40 |
0.30 |
0.30 |
||
| 30 |
0.40 |
0.30 |
0.30 |
||
| 40 |
0.32 |
0.34 |
0.17 |
||
| 50 |
0.32 |
0.34 |
0.17 |
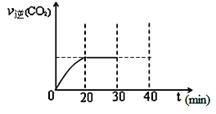
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在图中画出30min至40min的变化曲线。
粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如下图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。
(2)滤渣B的主要成分与NaOH溶液反应的离子方程式为________。
(3)步骤③中用NH4HCO3调节pH的实验原理为__________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、_________,得到的晶体主要成份是_________(填化学式)。第⑥步生成Al(OH)3的离子方程式为_________。
已知实验室制取Cl2的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为
(2)已知硫酸铅不溶于水,铅蓄电池的工作原理为Pb+PbO2 +2H2SO4 =2PbSO4+2H20,写出该反应的离子方程式 ;溶液中硫酸根离子检验的方法为 。
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4 +2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S 溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 ,属于非电解质的有 。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为 。
(3)除去③中少量②的操作是 ,化学方程式为 。
(4)标准状况下,___________L ④中含有0.4mol 氧原子。
(5)现有100 mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 。
(6)若在⑦中缓慢加入⑥,产生的现象是 。
(7)将①加入到⑧中,⑧的导电能力变化为__________(填“增强”、“减弱”或“基本不变”)。
(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是 ,属于电解质的是 。(填编号)
(2)现有:①铝、②二氧化硅、③二氧化硫、④二氧化碳、⑤三氧化二铁、⑥氢氧化钠、⑦氢氧化镁、⑧氢氧化铝、⑨氢氧化铁,能形成酸雨的是________;光纤制品的基本原料是__________;属于两性氢氧化物的是___________;红棕色固体是_____________。(填编号)
(3)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于 效应。
(4)胃舒平是治疗胃酸(盐酸)过多的常用药物。其中含有的有效成分是氢氧化铝,其治疗原理是(用化学方程式表示): ;碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式 。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。
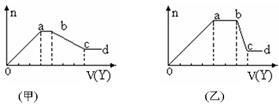
(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)溴元素在周期表中的位置为 。
(2)下列说法中正确的是 。
| A.CCl4和XeF2分子中各原子最外层均满足8e-结构 |
| B.Cl2O5和Cl2O7都是酸性氧化物 |
| C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸 |
| D.F-、Cl-、Br-、I-等离子的还原性逐渐增强 |
(3)已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。HF的电子式为 ;从HF、HCl混合气体中分离出HF的方法是 。
(4)向NaClO浓溶液中加入Al2(SO4)3浓溶液,迅速生成大量白色沉淀,同时有无色气体产生。生成白色沉淀的离子方程式为 。无色气体的成分为 。
(5)潮湿的氯气与碳酸钠粉末反应可用于制取氯的最低价氧化物,反应还同时生成两种盐,该反应的化学方程式为 。
(6)已知:还原性HSO3¯>I¯,氧化性IO3¯> I2,在下图中画出向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线。

某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 |
物质的量浓度(mol/L) |
| |
|
| |
|
(3)试确定K+是否存在?________,如果存在物质的量浓度为__________,如果不存在理由是__ _。