已知实验室制取Cl2的反应为:MnO2+4HCl(浓)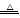 MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为
(2)已知硫酸铅不溶于水,铅蓄电池的工作原理为Pb+PbO2 +2H2SO4 =2PbSO4+2H20,写出该反应的离子方程式 ;溶液中硫酸根离子检验的方法为 。
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4 +2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S 溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有, ,可能含有 。
(2)写出上述实验中一定发生的有关反应的离子反应方程式: 。
现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 ,属于非电解质的有 。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为 。
(3)除去③中少量②的操作是 ,化学方程式为 。
(4)标准状况下,___________L ④中含有0.4mol 氧原子。
(5)现有100 mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 。
(6)若在⑦中缓慢加入⑥,产生的现象是 。
(7)将①加入到⑧中,⑧的导电能力变化为__________(填“增强”、“减弱”或“基本不变”)。
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。

(1)写出反应②和④的离子方程式
② 。
④ 。
(2)溶液中含有的离子是 ,它们的物质的量浓度之比为 。
某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则加入的检验试剂依次分别是 (写化学式);写出最后检验出的离子与所加试剂反应的离子方程式 。
现有五种溶液,分别含下列离子:①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+。
(1)写出符合下列条件的离子符号:
滴加氯水有明显现象的离子是 ,加铁粉后溶液增重的是 ;
(2)向③的溶液中滴加NaOH溶液,现象是 ,反应过程中属于氧化还原反应的化学方程式 。
(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是 ,属于电解质的是 。(填编号)
(2)现有:①铝、②二氧化硅、③二氧化硫、④二氧化碳、⑤三氧化二铁、⑥氢氧化钠、⑦氢氧化镁、⑧氢氧化铝、⑨氢氧化铁,能形成酸雨的是________;光纤制品的基本原料是__________;属于两性氢氧化物的是___________;红棕色固体是_____________。(填编号)
(3)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于 效应。
(4)胃舒平是治疗胃酸(盐酸)过多的常用药物。其中含有的有效成分是氢氧化铝,其治疗原理是(用化学方程式表示): ;碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式 。
铁、铝、铜都是中学化学常见的金属.
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为: 。
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为: 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 。
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,
4Fe+10HNO3="4" Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是 ,第二个反应每生成1molNH4NO3,被还原的硝酸的物质的量是 。
③如何检验NH4NO3溶液中的NH4+离子,请描述操作 ,写出相关的离子反应方程式 。
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入 。
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母) 。
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
将镁、铝的混合物共0.2 mol,溶于200mL 4mol/L的盐酸溶液中,然后再滴加2 mol/L 的NaOH溶液。请回答下列问题:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Al)= mol;
(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)= mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol/L的硫酸溶解此混合物后,再加入840mL 2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。则a的取值范围为 。
I.(1)鉴别KCl溶液和K2CO3的试剂是 ,除去SO2中的HCl的试剂是 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法。分离碘和CCl4的操作方法 。
(3)除去混入Fe2O3中少量SiO2杂质的试剂是 ,离子方程式为 。
II.氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(4)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________。(填“氧化性”或“还原性”)
(5)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收,服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中维生素C所起的作用是 。(填“氧化剂”或“还原剂”)
(6)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________。
| A.若管道漏气遇NH3就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理: 。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式 。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式: 。
II、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理: 。
写出在氨气的出气口处,检验有氨气生成的操作:
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因: 。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式: ;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是 (填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式 。
Ⅰ.请回答:
(1)燃着的钠不能用CO2灭火,其理由 (用化学方程式表示)。
(2)完成以下氧化还原反应的离子方程式:
( )Fe3++( )ClO-+______=( )FeO42-+( )Cl-+( )H2O
(3)剧毒物氰化钠的电子式为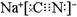 ,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
II.化合物A是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
A(s)+H2(g)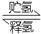 B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4.48L气体D (已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色。
(1)A的化学式为 ,LiH中r(Li+) r(H-)(填“大于”或“小于”)。
(2)写出液氨与金属锂反应的化学方程式 。
(3)B在加强热时生成NH3和另一种化合物E,该分解反应的化学方程式为 。
(4)化合物E也可以作储氢材料,其储氢原理可表示为:
E(s)+H2(g)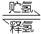 A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
储氢材料可以通过加热的方式释放氢气。从实用化角度考虑,选择 (填“A”或“E”)作储氢材料更合理,理由是 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。(已知25℃Ksp[Fe(OH)3]=4.0×10﹣38 lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是____________ 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为_________________(填写数值)。
(2)将FeCl3溶液与NaHCO3 溶液混合,其离子方程式为 _______________。
(3)25℃时pH=3的溶液中,c(Fe3+)= mol•L﹣1要使Fe3+ 沉淀完全,pH应大于________。
(4)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3=CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为__________。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。