(1)PH=10的Na2CO3溶液、NaOH溶液和PH=4的NH4Cl溶液、HCl溶液中水的电离程度的大小关系是 。(用化学式表示)
(2)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(3)NH4HSO4的电离方程式为
(1)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度。
①盛装0.2000 mol/L盐酸标准液应选用的滴定管是_________(填字母序号)。
②当接近滴定终点时,很少量的碱或酸就会引起溶液的 突变。
③有关数据记录如下:
| 实验编号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| I |
20.00 |
0.50 |
20.70 |
| II |
20.00 |
6.00 |
26.00 |
| III |
20.00 |
1.40 |
21.20 |
根据数据计算NaOH溶液的物质的量浓度是______________mol/L。
④若只用蒸馏水冲洗锥形瓶,则测定结果_________(填“无影响”.“偏高”或“偏低”)。
(2)25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
| 实验编号 |
c(HA)/mol﹒L-1 |
c(NaOH)/mol﹒L-1 |
混合溶液的pH |
| I |
0.2 |
0.2 |
pH=a |
| II |
c1 |
0.2 |
pH=7 |
| III |
0.2 |
0.1 |
pH>7 |
| IV |
0.1 |
0.1 |
pH=9 |
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a_____7(填“>”“<”或“=”),则HA为强酸。
②在II组实验的混合溶液中,c(A-)______ c(Na+)(填“>”“<”或“=”)。
③不考虑其它组实验结果,单从III组实验情况分析,HA是_____酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:_________________,____________________。
④IV组实验的混合溶液中,由水电离出的c (OH-)=___________。
(现有下列6种物质:①稀豆浆 ②K2CO3溶液③Cl2 ④SO2 ⑤稀盐酸 ⑥氢氧化钠。其中属于胶体的是 (填序号、下同),属于非电解质的是 ,属于单质的是 ,属于电解质的是 。KHCO3的电离方程式是 。
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:
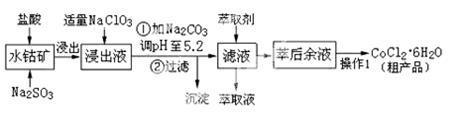
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________、________________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为 。
(5)萃取剂的作用是 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________。
镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________。
(3)从海水中提取金属镁用到的主要化学药品有________________。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下:
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________.
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药物,右图是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用最灵敏的检验试剂为_______(填试剂的名称)。
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为:_____________________________。
(3)称量上述含铁元素质量分数为20.00%的“速力菲”20.00g,将其全部溶于稀硫酸中,配制成1 000.00mL溶液.取出20.00mL,用0.01mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如下图所示。
①仪器A的名称是________:由上图可知消耗KMnO4溶液体积为_________ mL;
②滴定终点观察到的现象为______________________________;
③以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是________。
| A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出 |
| B.滴定前俯视,滴定后仰视(标准液) |
| C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁 |
| D.未用标准KMnO4溶液润洗滴定管 |
④该药品可以服用吗?_____(填“可以”或“不可以”)
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下

步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 ;若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不再用盐酸,为什么?
(2)选择的还原剂时否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉cmol/L高锰酸钾溶液bmL,则样品中铁元素的质量分数是 。
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取钴的氧化物的流程如下:
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是____________。
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为_____________________。
(3)步骤Ⅲ中的反应为2Na++6Fe3++4SO42-+12H2O=Na2Fe6(SO4)4(OH)12+12H +。过滤后母液的pH = 2.0,c(Na+) ="a" mol·L-1,c(Fe3+) ="b" mol·L-1,c(SO42-)=" d" mol·L-1,该反应的平衡常数K=___(用含a 、b 、d 的代数式表示)。
(4)完成步骤Ⅳ中反应的离子方程式:
□_______+□CO32-+□H2O=Co5(OH)6(CO3)2↓+□_____
(5)已知CoCl2的溶解度曲线如图所示。步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤。
①边加热边搅拌的原因是______________;
②趁热过滤的原因是______________。
将铁投入到稀硝酸溶液中,会发生如下反应:
Fe + 4HNO3(稀) = Fe (NO3)3 + NO↑ + 2H2O
(1)用双线桥法标出电子转移的方向和数目
(2)已知反应过程中消耗了28g铁,则转移电子的物质的量为 ,被还原的硝酸的物质的量为 。
(3)请将以上反应改写为离子方程式 。
按要求作答:
(1)石灰石与稀硝酸反应的离子方程式:_____________________________
(2)硫酸铜溶液与氢氧化钾溶液反应的离子方程式:_____________________
(3)写出HCl只做氧化剂的反应化学方程式:______________________________
(4)写出碳单质做还原剂的反应化学方程式:________________________________
在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如下图所示,则:

(1)“O”点导电能力为0的理由是_________________________。
(2)用湿润的pH试纸测量a处溶液的pH,测量结果_________(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①pH:__________ ;
②醋酸的电离度:_________ ;
③醋酸的电离平衡常数:__________ ;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:___________。
(4)若使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施有(答二类不同的物质):
①___________________②_____________________。
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是 。
| A.c(H+) | B.H+个数 | C.CH3COOH个数 | D.c(H+)/c(CH3COOH) |
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NAOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NAOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=A |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中C(A-)和C(NA+)的大小关系是
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
C(NA+)-C(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的NA2B溶液中,下列粒子浓度关系式正确的是________。
A.C(B2-)+C(HB-)=0.1 mol/L
B.C(B2-)+C(HB-)+C(H2B)=0.1 mol/L
C.C(OH-)=C(H+)+C(HB-)
D.C(NA+)+C(OH-)=C(H+)+C(HB-)
(III)已知:25 ℃时,Ksp(BASO4)=1×10-10,Ksp(BACO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BASO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BASO4仍然是安全的,BASO4不溶于酸的原因是(用溶解平衡原理解释)___________________________。
万一误服了少量BACO3,应尽快用大量0.5 mol/L NA2SO4溶液给患者洗胃,如果忽略洗胃过程中NA2SO4溶液浓度的变化,残留在胃液中的BA2+浓度仅为_____mol/L。
钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④X的最外层电子数是其电子层数的2倍;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)Z元素在元素周期表中的位置为_________,化合物WY的电子式为_______________________________。
(2)实验室用 WX2与饱和食盐水来制某种气态有机化合物,反应的化学方程式为
___________________________________________________________________________。
(3)Cu2Z与过量浓硝酸反应有红棕色气体生成,反应的离子方程式为
______________________________________________________________________________。
研究N0x、SO2等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为 。利用反应:6NO2+8NH3 7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1;
2SO3(g) ΔH=-196.6 kJ·mol-1;
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1;
2NO2(g) ΔH=-113.0 kJ·mol-1;
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="_________" kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
SO3(g)+NO(g)的ΔH="_________" kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
①该酸雨中肯定存在的离子有_______;肯定不存在的离子有______,说明其不存在的理由:_____。
②写出试液中滴加淀粉KI溶液所发生反应的离子方程式:____________。
③该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2 、 NO2+SO2=SO3 + NO,再喷射适量蒸馏水即得硫酸型酸雨。说明NO的作用:____________。