(1)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度。
①盛装0.2000 mol/L盐酸标准液应选用的滴定管是_________(填字母序号)。
②当接近滴定终点时,很少量的碱或酸就会引起溶液的 突变。
③有关数据记录如下:
| 实验编号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| I |
20.00 |
0.50 |
20.70 |
| II |
20.00 |
6.00 |
26.00 |
| III |
20.00 |
1.40 |
21.20 |
根据数据计算NaOH溶液的物质的量浓度是______________mol/L。
④若只用蒸馏水冲洗锥形瓶,则测定结果_________(填“无影响”.“偏高”或“偏低”)。
(2)25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
| 实验编号 |
c(HA)/mol﹒L-1 |
c(NaOH)/mol﹒L-1 |
混合溶液的pH |
| I |
0.2 |
0.2 |
pH=a |
| II |
c1 |
0.2 |
pH=7 |
| III |
0.2 |
0.1 |
pH>7 |
| IV |
0.1 |
0.1 |
pH=9 |
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a_____7(填“>”“<”或“=”),则HA为强酸。
②在II组实验的混合溶液中,c(A-)______ c(Na+)(填“>”“<”或“=”)。
③不考虑其它组实验结果,单从III组实验情况分析,HA是_____酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:_________________,____________________。
④IV组实验的混合溶液中,由水电离出的c (OH-)=___________。
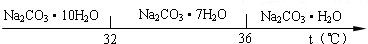
 3C+2D,A、B、C、D均为气体,且正反应△H= -akJ·mol-1(a>0)。
3C+2D,A、B、C、D均为气体,且正反应△H= -akJ·mol-1(a>0)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号