下列反应的离子方程式书写正确的是
| A.氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 |
| B.碳酸钙溶于醋酸:CaCO3 + 2H+ |
| C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O |
| D.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH- + HCO3- |
下列离子方程式正确的是( )
①氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
②氯气与氢氧化钠溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
③浓盐酸与二氧化锰共热:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O
④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
| A.①③ | B.②④ | C.②③ | D.①④ |
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
| A.Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓ |
| B.NH4++Fe3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O |
| C.2Fe3++ SO42-+ Ba2++6OH-=BaSO4↓+ 2Fe(OH)3↓ |
| D.3NH4++ Fe3++3SO42-+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O |
对下列反应:①NH4HCO3溶液与石灰水反应、②K2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列离子方程式正确的是
| A.钠与水反应:Na + 2H2O = Na+ + 2OH- + H2↑ |
| B.硅酸钠溶液与醋酸溶液混合:SiO32-+ 2H+ = H2SiO3↓ |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合: NH4+ +Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3- + 6H+ Fe3+ + 3NO2↑ + 3H2O Fe3+ + 3NO2↑ + 3H2O |
[2012·北京卷] 下列解释实验现象的反应方程式正确的是( )
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2==Na2O2 |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-==Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2===2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O |
下列反应的离子方程式正确的是
| A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3- |
| C.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+ |
| D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
下列表示对应化学反应的离子方程式正确的是( )
| A.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-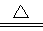 NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O |
下列离子方程式书写正确的是
| A.氯气溶于水:Cl2+H2O═2H++Cl﹣+C1O﹣ |
| B.溴化钠溶液与氯气反应:2Br﹣+Cl2═2Cl﹣+Br2 |
| C.氢氧化钡溶液与稀硫酸反应:H++SO42﹣+Ba2++OH﹣═H2O+BaSO42﹣↓ |
| D.碳酸钙加入过量的盐酸中:CO32﹣+2H+═CO2↑+H2O |
下列叙述正确的是
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D.向FeCl2溶液中通入Cl2反应的离子方程式为:Fe2++Cl2═Fe3++2C1﹣ |
下列离子方程式正确的是( )
| A.硫酸铝溶液加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| B.稀盐酸与碳酸钙反应:2H++CO32-=H2O+CO2↑ |
| C.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
| D.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
A. 稀释前,c(HB) > c(HA)="0.01" mol·L-1
B. HB的电离方程式为HB=H++B-
C. NaA的水溶液中,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+)
D. NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
下表是某铬酸(H2CrO4)溶液中离子浓度(mol.L-1)与pH的关系,下列说法不正确的是
| pH |
c(CrO42-) |
c(HCrO4-) |
c( Cr2O72-)] |
c(H2CrO4) |
| 4 |
0.0003 |
0.1040 |
0.4480 |
0 |
| 6 |
0.0319 |
0.0999 |
0.4370 |
0 |
| 7 |
0.2745 |
0.0860 |
0.3195 |
0 |
| 9 |
0.9960 |
0.0031 |
0.0004 |
0 |
A.铬酸的第一步电离是完全电离
B.铬酸的第二步电离是部分电离,且存在两种电离方式
C.当电离达到平衡时,2 (Cr2O72-)=
(Cr2O72-)= (HCrO4-)
(HCrO4-)
D.pH越大,电离出的CrO42-浓度越大
能正确表示下列化学反应的离子方程式的是
| A.氢氧化钡溶液与硫酸的反应 OH-+H+ = H2O |
| B.金属钠与热水反应 Na + H2O = Na++ OH- + H2 |
| C.铜片插入硝酸银溶液中 Cu +Ag+ = Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
下列化学用语的表述对应正确的是
| A.碳酸氢钠的电离方程式:NaHCO3===Na++H++CO32- |
B.用铜做阳极电解氯化铜溶液的离子方程式:Cu2++2Cl-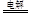 Cu+Cl2↑ Cu+Cl2↑ |
C.硫化钠水解的离子方程式:S2-+2H2O H2S+2OH- H2S+2OH- |
D.碳酸钙的溶解平衡:CaCO3(s)  Ca2+(aq) + CO32-(aq) Ca2+(aq) + CO32-(aq) |