[江西]2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷
下列变化规律不正确的是 ( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
若NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
①标准状况下,2.24L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为a/22.4 NA
③电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
④7g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA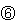 标况下22.4LNO和11.2LO2混合后所得气体分子数为NA
标况下22.4LNO和11.2LO2混合后所得气体分子数为NA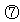 2L1mol/L的盐酸中所含氯化氢分子数为2NA
2L1mol/L的盐酸中所含氯化氢分子数为2NA
A.①④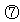 |
B.②⑤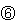 |
C.③④⑤ | D.②⑤ |
下列判断中一定正确的是( )
| A.等物质的量的CaCl2及CaO2固体中阴、阳离子数之比均为2∶1 |
| B.等质量的O2与O3中,氧原子的个数比为3∶2 |
| C.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶2 |
| D.10mL 0.3mol·L-1NaCl与30mL0.1mol·L-1AlCl3溶液中Cl-物质的量浓度比为1∶3 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是: ( )
① 氧化剂是H3AsO3; ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
在容积为2L的密闭容器中,有反应:mA (g) + nB (g)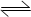 pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min), C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min), C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
| A.3:1:2:2 | B.1:3:2:2 | C.1:3:2:1 | D.1:1:1:1 |
2a L Fe2(SO4)3和(NH4)2SO4的混合溶液分成两等份,向其中一份加入b mol的BaCl2溶液,恰好使溶中的SO42-完全沉淀;向另外一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为( )mol·L-1
A.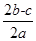 |
B.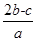 |
C.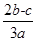 |
D.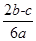 |
下列表示对应化学反应的离子方程式正确的是( )
| A.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH- NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O |
下列有关叙述正确的是( )
| A.铝和铁在常温下遇硫酸或硝酸发生钝化现象 |
| B.金属钠除保存在煤油中,也可以保存在汽油中 |
| C.湿法冶炼就是指金属在溶液中的置换反应,如金属钠置换硫酸铜溶液中的铜 |
| D.涂油层、电镀金属层、制合金等都是保护金属的措施 |
FeS2结构类似于Na2O2,与酸反应时生成H2S2,H2S2类似于H2O2,易分解。实验室用稀盐酸制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质是:( )
| A.H2S | B.S | C.FeS | D.FeCl2 |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是
| A.c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + c (C2O42-) |
| B.c (C2O42-) < c (H2C2O4) |
| C.c (HC2O4-) + c (C2O42-) =" 0.1" mol·L-1 |
| D.c (K+) =" c" (H2C2O4) + c (HC2O4-) + c (C2O42-) |
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加人Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是 ( )
| A.图中C点铝元素存在形式是AlO2— |
| B.向D点溶液中通人C02气体,立即产生白色沉淀. |
C.原混合液中 |
| D.OA段反应的离子方程式为: |

某恒温密闭容器发生可逆反应Z(?)+W(?) X(g)+Y(?) ΔH>0 ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH>0 ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
| A.Z和W在该条件下一定不为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C.若在该温度下此反应平衡常数表达式为K=C(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D.该反应的平衡常数K随温度升高而增大 |
已知25℃时,Ksp[Cu(OH)2]=2×10-20。要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为( )
| A.4 | B.6 | C.8 | D.10 |
用惰性电极电解100mL4mol ·L-1的CuSO4溶液,一定时间后在阳极收集到1.12 L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )
| A.2.7 mol· L-1 | B.3 mol· L-1 | C.4 mol· L-1 | D.1 mol· L |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是( )
| A.Cu与Cu2O 的物质的量之比为2:1 | B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L | D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如图。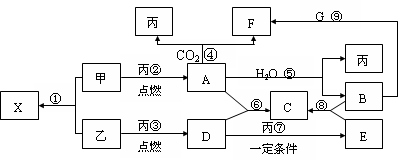
请回答:
(1) 写化学式:丙_________,E________。
(2)X的电子式为____________________。
(3) 写出A与H2O反应的化学反应方程式:_______________ ___ ________ 。
(4)写出B与G溶液反应生成F的离子方程式:___________ _ ____________。
(5)在上图的反应中,不属于氧化还原反应的是(填序号)______________。
下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。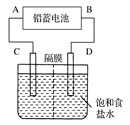
已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+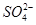 -2e-===PbSO4
-2e-===PbSO4
正极 PbO2+4H++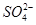 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式 。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 ,该反应的熵变⊿S 0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表: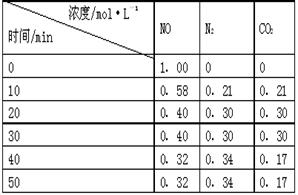
①10min~20min以V(CO2) 表示的反应速率为 。
②该反应的平衡常数的表达式为:K= ,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③下列各项能作为判断该反应达到平衡的是 (填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
某化学研究性学习小组探讨Fe3+和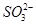 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为____________________________________。
乙同学认为发生双水解反应,其反应方程式为2Fe3++3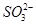 +6H2O===2Fe(OH)3(胶体)+3H2SO3。
+6H2O===2Fe(OH)3(胶体)+3H2SO3。
……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是___ _____。
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:________________ ____________。
②实验③中溶液变成血红色的有关离子方程式为_________ _______________。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是________ __________________。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除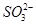 水解能力较
水解能力较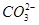 小外,还有_ _______。
小外,还有_ _______。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号