粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:
请回答下列问题:
(1)操作i所需要的玻璃仪器有: (填序号)。
a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗
(2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。
(4)写出生成固体H的离子方程式 。
(5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量:
①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是
(请用化学方程式表示)。
②判断滴定终点的现象为 。
③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KI溶液体积/mL |
30.00 |
32.20 |
30.02 |
29.98 |
则该粉煤灰中Fe元素的质量分数为 (保留三位有效数字)。
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是
(请用离子方程式及简单的文字描述)。
某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:

已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是 (写2点)。
(2)固体混合物A中的成分是 。
(3)反应I完成后,铁元素的存在形式为 (填离子符号);写出生成该离子的离子方程式 。
(4)操作1主要包括: 、 、 。洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为 .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀 时的pH |
完全沉淀 时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO E.增大压强 |
(2)又知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
写出C(s)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式 。
(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
若用该电池提供的电能电解600mLNaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所x需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 4.5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。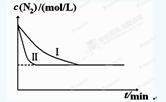

图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
I. 铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)溶液B经过 、 、 可得到氯化铜晶体;
(2)检验溶液B中是否存在Fe3+的方法是 ;
(3)下列物质适合于调节溶液的pH得溶液B的是
A.NaOH溶液 B.CuCO3 C.氨水 D CuO
(4)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 ;
II. (1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①若氨水与 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水

②向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)此时溶液中 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(2)向0.2mol•L‾1 NaOH 溶液通入过量CO2,充分反应后所得溶液中离子浓度大小顺序为
___________________________________ 。
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式 。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是 。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是 。
(5)若A是一种溶液,只可能含有 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下: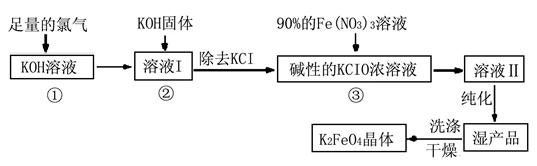
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。要制得69.3克K2FeO4,理论上消耗氧化剂的物质的量为 mol。
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,
放电时电池的负极反应式为 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式 。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式 。
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。

结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 。
钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。
(1)请写出FeTiO3与稀盐酸反应的离子方程式: 。
(2)请写出“熔融氧化”的化学方程式: 。
(3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式)。
(4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: 。
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式)。
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
氨水物质的量浓度/(mol·L-1) |
盐酸物质的量浓度/(mol·L-1) |
混合溶液pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。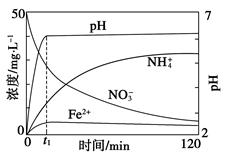
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下: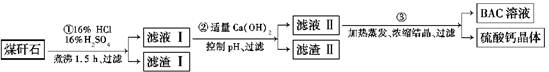
(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式:_______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
硅孔雀石是一种含铜的矿石,含铜形态为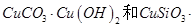
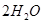 ,同时含有
,同时含有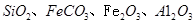 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图: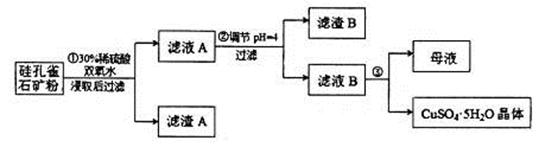
请回答下列问题:
(1)完成步骤①中稀硫酸与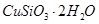 发生反应的化学方程式
发生反应的化学方程式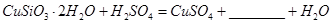 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A.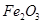 |
B.CuO | C.A12O3 | D.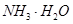 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表: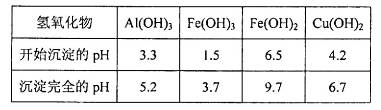
由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到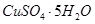 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,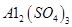 饱和溶液中
饱和溶液中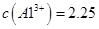 mol
mol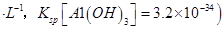 ______________。
______________。
(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
| A.饱和食盐水 | B.碱石灰 |
| C.浓硫酸 | D.水 |
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________________。
③滴定终点的现象是_______________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2 mg·L-1。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是________(填化学式),其发生反应的离子方程式为_________________________________________________________________。
某课外小组对一些金属单质和化合物的性质进行探究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应_________________________________________________________;
化合反应_________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是__________________________________________________。
解释此现象的离子方程式是___________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_______________________。