下列各反应的化学方程式中,不正确的是
A.将点燃的镁条伸入充满CO2气体的集气瓶中:2Mg + CO2 2MgO+C 2MgO+C |
| B.大理石溶于醋酸:CO3 2- + 2CH3COOH = 2CH3COO- + CO2↑+ H2O |
| C.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全: Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O |
| D.向淀粉KI溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝: |
4H+ +4I- + O2 = 2I2 +2H2O
能正确表示下列反应的离子方程式是
A.将氯气溶于水制备次氯酸:Cl2 + H2O 2H+ + Cl-+ ClO— 2H+ + Cl-+ ClO— |
| B.碳酸氢铵与过量的NaOH溶液反应:NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O |
| C.NaOH溶液中通入少量二氧化硫:SO2+ 0Hˉ= HSO3- |
| D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
下列离子方程式正确的是
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
下列指定反应的离子方程式正确的是
| A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
下列离子方程式正确的是
| A.将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH—==CaCO3↓+H2O |
| B.Fe(OH)3溶于氢碘酸: Fe(OH)3 + 3H+ ==Fe3+ + 3H2O |
| C.向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42ˉ离子沉淀完全Al3+ + 2SO42ˉ + 2Ba2+ + 4OHˉ ==Al(OH)4ˉ + 2BaSO4↓ |
D.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++ 2OH-+NH4++ HCO3- NH3↑+2H2O+BaCO3↓ NH3↑+2H2O+BaCO3↓ |
(本小题满分14分)
I.H2A在水中存在以下平衡:H2A 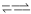 H++HA-,HA
H++HA-,HA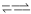 H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_____________。
A.c(Na+ )>c(K+ ) B.c(H +)•c(OH )=1×10-14
C.c(Na+ )=c(K+ ) D.c(Na+ )+c(K+ )=c(HA )+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) 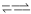 Ca2+ (aq)+A2- (aq)
Ca2+ (aq)+A2- (aq)
滴加少量Na2A固体, c(Ca2+ )_____________(填“增大”、“减小”或“不变”),原因是______________。
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L 的Cr2O7。为使废水能达标排放,作如下处理:
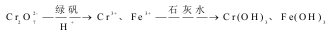
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_____________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入_____________g FeSO4·7H2O。
(3)若处理后的废水中残留的 c(Fe )=1×10-13mol/L ,则残留的 Cr3+的浓度为____________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,根据要求解决下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
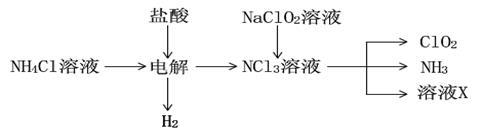
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)为了测定混合气体中ClO2的含量,我们通常用酸化的KI溶液与之反应。
①请写出ClO2与碘化钾反应的离子方程式为 。
②如果反应过程中共消耗了 0.04 mol的KI,则此混合气体中ClO2的质量为________克。
(12分)高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
下列离子方程式错误的是
| A.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| B.Cl2通入NaOH溶液:Cl2+2OH-=Cl-+ClO-+H2O |
| C.等物质的量的MgCl2、Ba(OH)2和HC1 溶液混合:H++ Mg2++3OH-= Mg(OH)2↓+H2O |
| D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e- = PbO2+4H++SO42 - |
能正确表示下列反应的离子方程式的是
| A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+===Fe2++2Fe3++4H2O |
| B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O===HClO+ HSO3- |
| D.将0.2 mol·L-1 NH4Al(SO4)2溶液与0.3 mol·L-1 Ba(OH)2溶液等体积 |
混合:2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
下列离子方程式正确的是
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
| 编号 |
化学反应 |
离子方程式 |
评 价 |
| A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH =CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
| B |
NaAlO2溶液中通入过量CO2 |
2AlO2-+CO2+3H2O==2Al(OH)3↓+CO32- |
正确 |
| C |
NaHCO3的水解 |
HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
错误,水解方程式误写成电离方程式 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl - |
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的 I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2, 溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ 。向反应后的溶液中通入过量CO2,反应的离子方程式为 _______________________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
下列离子方程式书写及评价合理的是
| |
离子方程式 |
评价 |
| A |
Mg(HCO3)2溶液中加入足量的NaOH溶液Mg2++2HCO3-+2OH-=MgCO3↓+ CO32-+ 2H2O |
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水; |
| B |
1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO2-+5H+ =Al3+ +Al(OH)3↓+H2O |
正确,AlO2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+ |
| C |
将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8 H+= Fe2+ + 2Fe3+ + 4H2O |
正确,Fe3O4化学式可改写为FeO·Fe2O3,Fe2+与Fe3+物质的量之比为1:2 |
| D |
将FeCl2溶液加入到NaClO溶液中 Fe2+ +2ClO-+2H2O = Fe(OH)2↓+2HClO |
错误,Fe2+与ClO-会发生氧化还原反应: 2Fe2+ +ClO-+5H2O =2Fe(OH)3↓+ Cl-+4H+ |