下列离子方程式书写正确的是


①向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + 2SO42-+ 2 Ba2+ + 4OH-= AlO2-+ 2BaSO4↓+ 2H2O
②向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+ = Fe2++2H2O
③向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O
④向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+OH- CH2BrCOO-+H2O
CH2BrCOO-+H2O
⑤向含0.5mol溴化亚铁溶液中通入0.5mol氯气2Fe2++Cl2=2Fe3++2Cl-
⑥澄清石灰水中滴加少量碳酸氢钙溶液Ca2++OH-+HCO3-=H2O+CaCO3↓
⑦氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O
⑧小苏打与甲酸溶液混合H++CO32-+HCOOH=CO2↑+HCOO-+H2O
| A.②④ | B.①⑥ | C.③⑤⑥ | D.①③⑦ |
下列反应的离子方程式正确的是
A.向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN﹣ Fe(SCN)3↓ Fe(SCN)3↓ |
| B.向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
| D.用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣ |
下列离子方程式正确的是
| A.向FeSO4溶液中加入少量Na2O2:4Na2O2+6H2O+4Fe2+===4Fe(OH)3↓+8Na++O2↑ |
| B.向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀的质量最大:2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓ |
| C.向NaClO溶液中通入少量SO2: 2ClO-+SO2+H2O===2HClO+SO32- |
| D.将0.2 mol/L的NH4Al(SO4)2溶液与0.4 mol/L的Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O |
下列离子方程式正确的是
| A.过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2====Fe3++Br2+4Cl- |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O |
| C.碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++ OH—+HCO3—=CaCO3↓+ H2O |
| D.用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+ |
下列离子方程式中,正确的是
A.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH-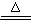 NH3↑+ H2O NH3↑+ H2O |
| B.氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O |
| C.向BA(OH)2溶液中滴加NAHSO4溶液至恰好为中性:BA2+ + OH- + H+ + SO42- = BASO4↓+ H2O |
| D.石灰石与盐酸反应:CACO3+2H+=CA2++CO2↑+H2O |
能正确表示下列反应的离子方程式是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C.向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:

(1)反应生成ClO2气体需要X酸酸化,X酸可以为 。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为 。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。写出pH≤2时ClO2与S2-反应的离子方程式_______ 。

(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式_____ _______;处理100 m3这种污水,至少需要ClO2 _____________ mol。
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe |
(1)已知下列反应在一定条件下可以发生:
H 2 O 2 +2Fe 2+ +2H + ="2Fe" 3+ +2H 2 O H 2 O 2 +2Fe 3+ ="2Fe" 2+ +O 2 ↑+2H +
(1)在以上反应中Fe 2+ 实际上起着_________作用,总反应式为______________。
(2)I 2 也与Fe 2+ 一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:
H2O2 +I2 =2HIO______________总反应式为_______________。
(3)在H 2 SO 4 和KI的混合溶液中加入足量的H2O2 ,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2 +2I-=I2 +O2↑+2H+ ,这个方程式正确吗?__________。若正确,理由是(若认为不正确,该步不必作答)___________。若不正确,原因是(若认为正确,该步不必作答)__________________,并写出正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式):________________。
下列选项正确的是
| A.使pH试纸变成红色的溶液中,可能存在大量的:NH4+、Cu2+、ClO﹣、Cl﹣ |
| B.(NH4)2Fe(SO4)2溶液中,可能存在大量的:K+、Cu2+、Cl﹣、MnO4﹣ |
| C.硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I﹣+O2+2H2O=2I2+4OH﹣ |
| D.NaHCO3溶液中滴加少量澄清石灰水:2HCO3﹣+Ca2++2OH﹣=CaCO3↓+2H2O+CO32﹣ |
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________.
下列离子方程式与所述事实相符且正确的是
| A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O=MnO2↓+Cl-+2H+ |
| B.用稀硝酸清洗做过银镜反应的试管:Ag+NO3-+4H+=Ag++NO↑+2H2O |
| C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl- |
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液: 2Cl-+2H2O H2↑+Cl2↑+2OH - H2↑+Cl2↑+2OH - |
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
| A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ |
| B.溶液中一定不含CO32-和NO3-,一定含有SO42- |
| C.溶液中c(NH4+)=0.3 mol/L |
| D.c(H+)∶c (Al3+)∶c(Mg2+)=1∶1∶1 |
下列有关NaClO和NaCl混合溶液的叙述正确的是
| A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存 |
| B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 |
| C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O[Z |
| D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
(21分)过氧化氢常用作氧化剂、漂白剂和消毒剂,可用于甲型H1N1流感消毒,为了贮存运输和使用的方便,工业上采用“醇析法”,将它转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和Na2O2的双重性质,工业“醇析法”的工艺如下:

回答下列问题:
(1)过氧化氢溶液加入二氧化锰的反应化学方程式为_____________。
(2)反应温度控制在0~5 ℃时进行的理由是___________。
(3)稳定剂能相互反应,生成一种不溶物将过碳酸钠粒子包住,该反应的化学方程式为_________。
(4)加入异丙醇的作用是___________。
(5)下列物质不能使过碳酸钠较快失效的是________。
a.FeCl3 b.Na2S c.CH3COOH d.NaHCO3
(6)根据题中有关信息,请你提出贮存、运输过碳酸钠晶体中应注意(至少两项):___________。
(7)某同学向酸性高锰酸钾溶液中滴入过量过氧化氢溶液,观察到高锰酸钾溶液褪色,则发生反应的离子方程式为__________。