某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,现设计如下综合利用的主要流程。试推断:
(1)方框内物质A和B的化学式:A ;B ;
(2)第③步通入B的离子方程式为 ___。
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
下列离子方程式书写正确的是
| A.AlCl3溶液与过量的浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| B.向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4 Fe3++2H2O |
| D.CuSO4溶液与少量的Ba(OH)2溶液:Ba2+十SO42-=BaSO4↓ |
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 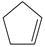 (g) =
(g) = 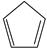 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 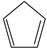 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 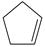 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
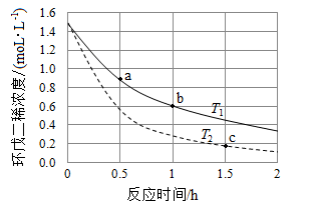
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
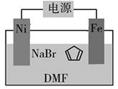

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为________,其中氮的化合价为________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________.
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=________,联氨和N2O4可作为火箭推进剂的主要原因为________.
(4) 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________.
某校学生课外活动小组为测定Na元素的相对原子质量,甲同学设计的装置如右图,该装置(包括仪器、水和干燥剂)的总质量为ag,从实验室取出b g的钠(不足量,不含煤油)放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)该反应的离子方程式为 ;
(2)此干燥管的作用是 ;若此钠块有少量被氧化,则测出的相对原子质量会比实际相对原子质量 (填“偏大”、“偏小”或“不变”);
(3)乙同学认为此设计方案会使测定结果 (填“偏大”、“偏小”或“不变”),建议在图中干燥管上再连一个同样的干燥管且该干燥管不参与称质量,其目的是 ,计算钠的相对原子质量的表达式为____________;
(4)丙同学为避免由于行动不够迅速产生偏差,又建议在广口瓶中再加入一定量煤油,其目的是_ ___。
下列解释事实的离子方程式不正确的是
| A.Na放入水中,产生气体:2Na + 2H2O =2Na+ + 2OH-+ H2↑ |
| B.FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3+ + 2I-= 2Fe2+ + I2 |
| C.铁溶于稀硝酸,溶液变黄:3Fe + 8H+ + 2NO3-= 3Fe2+ + 2NO↑+ 4H2O |
| D.Al片置于NaOH溶液中,产生气体:2Al + 2OH-+ 2H2O =2AlO2- + 3H2↑ |
下列反应的离子方程式书写正确的是
| A.硫酸和氯氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B.碳酸钠与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O |
| C.Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D.铁钉放入硫酸铁溶液中:Fe+Fe3+=2Fe2+ |
能用H+ + OH- =H2O 来表示的化学反应是( )
| A.固体C u ( O H ) 2和H2SO4溶液反应 |
| B.澄清石灰水和HNO3溶液反应 |
| C.KOH 溶液和醋酸溶液反应 |
| D.Ba(OH)2溶液和H2SO4溶液反应 |
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO3-+H+ HCO3-+H+ |
C.CO32-+ H2O  HCO3-+OH- HCO3-+OH- |
D.HS- S2-+H+ S2-+H+ |
下列离子方程式中,正确的是
| A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B.氯化铁溶液与铁反应:Fe3++Fe = 2Fe2+ |
| C.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O |
| D.氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+ |
下列离子方程式书写正确的是
| A.氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B.盐酸滴入澄清石灰水中:Ca(OH)2+2H+=Ca2++2H2O |
| C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| D.铜与硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag |
能正确表示下列反应的离子方程式的是
| A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑ |
B.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32- H3O+ +CO32- |
| C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O |
| D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
下列实验设计及其对应的离子方程式均正确的是
| A.Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O—+ SO2+H2O = CaSO3↓ + 2HC1O |
| B.澄清石灰水与过量小苏打溶液混合:Ca2+ + 2OH-+ 2HCO3- = CaCO3↓ + H2O + CO32— |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+ CO2 + H2O = H2SiO3↓ + CO32— |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4—+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O