离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
| A.①③ | B.①④⑤ |
| C.②④⑤ | D.①⑤ |
下列离子方程式中,正确的是
| A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑ |
| B.氧化铜与硫酸混合:Cu2++SO42-===CuSO4 |
| C.盐酸滴在石灰石上:CaCO3+2H+===H2CO3+Ca2+ |
| D.硫酸钠溶液与氯化钡溶液混合:Ba2++SO42-===BaSO4↓ |
能用H++OH-===H2O表示的是
| A.Ba(OH)2溶液和稀硫酸的反应 |
| B.NaOH溶液和盐酸的反应 |
| C.Cu(OH)2和稀硫酸的反应 |
| D.NaOH溶液和CO2的反应 |
“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液。某研究小组用该含碘废液制备NaI固体,实验流程如下:

已知:反应②2I﹣+2Cu2++SO32﹣+H2O═2CuI↓+SO42﹣+2H+
回答下列问题:
(1)产生含碘废液的离子方程式为 。
(2)①中I2与Na2SO3溶液反应的离子方程式为 。
(3)③中CuI发生了氧化反应,写出该反应的化学方程式 。
(4)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式
为 。
(5)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为 。
过氧化钠、过氧化镁、过氧化氢都是重要的过氧化物。回答下列问题:
(1)过氧化镁不溶于水,但易溶于稀酸。广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式: 。
(2)高温下,过氧化钠在隔绝空气环境中可以将铁单质氧化成含FeO42— 高铁酸盐,该反应的化学方程式为 。
(3)取少量含Fe2+、H+ 溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,其中包括的反应有 (写离子方程式);继续加H2O2,红色逐渐褪去且有气泡产生,反应原理为:H2O2 +SCN— →SO42- + CO2↑+ N2↑ + H2O +
(SCN— 中S为—2价,将方程式补充完成并配平)
已知溶液中:还原性HSO3一>I一,氧化性IO3一>I2>SO42-。向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
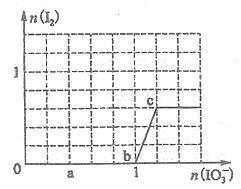
(1)写出a点反应的离子方程式 ,反应中还原剂是 ,被还原的元素是____ 。
(2)写出b点到c点反应的离子方程式 。
(3)若往100mLlmol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为____ 。
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作__________剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
____Cr2O72-+___SO32-+___ =___Cr3++___SO42-+_______H2O
=___Cr3++___SO42-+_______H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液I中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_____________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是_____________。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,则x的值等于__________ 。
下列离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
能正确表示下列反应的离子方程式的是
| A.Cl2通入NaOH溶液:Cl2+OH-===Cl-+ClO-+H2O |
| B.稀盐酸溶液中加入CaCO3:CO32-+2H+===CO2↑+H2O |
| C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O |
| D.Cu溶于稀HNO3:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O |
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入AgNO3溶液,有白色沉淀生成。
根据上述实验现象,判断原白色粉末中肯定含有 (填化学式,下同),可能含有 ,写出步骤(3)中发生反应的离子方程式: 。
写出下列反应的离子方程式。
①足量稀硝酸与CaCO3反应的离子方程式:
②稀硫酸和氢氧化钡溶液反应的离子方程式:
③等体积等物质的量浓度的碳酸氢钠溶液和氢氧化钡溶液反应的离子方程式:
下列各组反应,均可用同一离子方程式表示的是
| A.HCl和Na2CO3溶液反应, HCl溶液和CaCO3反应 |
| B.足量稀H2SO4和Na2CO3溶液反应,足量稀HNO3和K2CO3溶液反应 |
| C.稀H2SO4和Ba(OH)2溶液反应,稀H2SO4和KOH溶液反应 |
| D.BaCO3和稀 H2SO4溶液反应, BaCO3和稀HCl 溶液反应 |
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4。当醋酸铅溶液中通入硫化氢时,有黑色沉淀硫化铅和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是
| A.Pb(Ac)2+H2S=PbS↓+2HAc | B.Pb2++H2S=PbS↓+2H+ |
| C.Pb2++2Ac-+H2S=PbS↓+2HAc | D.Pb2++2Ac-+2H++S2- =PbS+2HAc |
下列离子方程式改写成化学方程式正确的是
| A.Zn2++2OH-=Zn(OH)2 ZnCO3+2NaOH=Zn(OH)2+Na2CO3 |
| B.Ba2++SO42-=BaSO4 Ba(OH)2+H2SO4=BaSO4+2H2O |
| C.Ag++Cl-=AgCl AgNO3+KCl=AgCl+KNO3 |
| D.Cu+2Ag+=Cu2++Ag Cu+2AgCl=CuCl2+2Ag |