下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
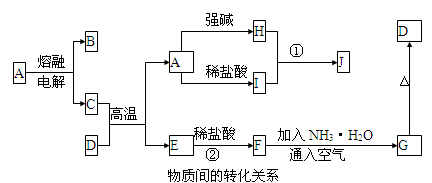
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
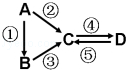
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物.D物质常用于食品工业.写出④反应的化学方程式 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.写出③反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.写出④反应的离子方程式 .
无机推断题组(一题多变题组)
已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出E中含有的化学键类型 ;已知1molA与水反应放出283.5kJ的热量,试写出A与水反应的热化学反应方程式 ;
(2)若A 为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则单质A与H2O反应的离子方程式 。
(3)若A 为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时,转移电子总数为 。
②若X为非金属单质,通常为黑色粉末,写出D的结构式 ;
(4)若A为氧化物,X是Fe,溶液D加入KSCN溶液变红。
①A与H2O反应的离子方程式 。
②请用离子方程式表示D盐的净水原理 。
A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。
(1)物质C俗称__________;物质B的一种用途________
(2)写出下列反应的化学反应方程式:
⑤ ____________________________
⑧ _____________________________
(3)写出反应的离子方程式:⑦______________________
(4)在①-⑧的所有反应中,属于非氧化还原反应的有(填序号)_________
(5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因________
(1)有A、B、C、D四种均含有铝元素的化合物,它们之间存在如下的反应关系:
① A+NaOH=D+H2O ② B=A+H2O ③C+NaOH(适量)="B+NaCl" ④C+D+H2O=B+NaCl
则A是 、C是 (填化学式)
(2)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式
若生成标况下2.24 L Cl2,则被氧化的HCl的物质的量为 。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: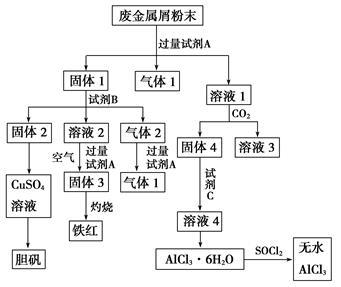
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是_________________。
(2)溶液2中含有的金属阳离子是__________;气体2的成分是______________。
(3)溶液2转化为固体3的反应的离子方程式是____________________________。
(4)利用固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是___________。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是_____________________________。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是__________________
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是______________。
已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
根据下面物质间转换的框图,回答有关问题:

(1)写出框图中物质A、D、F、G分别指代物质的化学式:
A. D. F. G.
(2)写出⑤反应的化学方程式 。
在⑤反应中当有6.6gD 足量的Na2O2参加反应时会造成固体增重 克 。
(3)写出④的离子反应方程式 。
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1) 图中涉及分离溶液与沉淀的方法是__________________。
(2) B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为
沉淀E与稀硫酸反应的离子方程式为
溶液G与过量稀氨水反应的化学方程式为
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 ;其水溶液中离子浓度由大到小的顺序是 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式 。
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
填写下列空白:
(1)写出化学式:A________,B_________,D_________E_______。
(2)以上反应中不属于氧化还原反应的有______________(填序号)。
(3)写出反应②④⑥的化学方程式:
②_______________________________。
④_______________________________。
⑥_______________________________。
(4)写出反应⑤的离子方程式:_____________________,写出铝粉和C溶液反应的离子方程式:___________________
已知:溶液E焰色反应为黄色。
根据以上转化关系,回答下列问题:
(1)写出下面物质的化学式:
A______________,B____________,C_______________,D_____________。
(2)写出下列离子方程式:
(Ⅰ)___________________________;
(Ⅱ)___________________________;
(Ⅲ)___________________________;
(Ⅳ)_______________________________。
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外,与盐酸反应时B还生成一种可燃气体,而与盐酸反应时C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出有关物质的化学式: A、________B、_________C、_________E、________
(2)写出F和H反应的化学方程式 。
(3)写出下列反应的离子方程式:
① D+盐酸 ② B+水
从海水中提取一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(1)图中A的化学式为____________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为_____________________。
(2)海水淡化处理的方法有______________________________。(写出3种即可)
(3)过程⑤的化学方程式为_________________________。
(4)从B溶液制备B的无水晶体的“操作a”为_____________________。
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式 ______________________________。
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是_____ 。
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32ˉ、SO42ˉ、SiO32ˉ、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。

请回答下列问题:
(1)沉淀K为 ,由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是__________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与02的物质的量之比为______________。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMn04溶液
⑥氯水和KSCN的混合溶液