13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空问结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖。下而有关13C、15N叙述正确的是
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为向位素
D.15N的核外电子数与中子数相同
卢瑟福发现铀产生的a、b、c三种射线在电场中有如图所示情况。下列认识错误的是
| A.c射线是带负电荷的电子流 |
| B.b射线是不显电性的波长很短的电磁波 |
| C.a射线是氦原子——α粒子 |
| D.在科学家的不懈努力下人类打开了原子结构的大门 |
13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构。下面有关13C、15N叙述正确的是
A、13C与15N有相同的中子数 B、13C与C60互为同素异形体
C、15N与14N互为同位素 D、15N的核外电子数与中子数相同
放射性同位素钬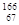 Ho的原子核内的中子数与核外电子数之差是
Ho的原子核内的中子数与核外电子数之差是
| A.32 | B.67 | C.99 | D.166 |
关于原子模型的演变过程,正确的是
| A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
| B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型 |
| C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型 |
| D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
放射性同位素钬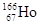 的原子核内的中子数与核外电子数之差是
的原子核内的中子数与核外电子数之差是
| A.32 | B.67 | C.99 | D.166 |
 是地壳中含量最高的稀土金属元素。下列关于
是地壳中含量最高的稀土金属元素。下列关于 的说法正确的是
的说法正确的是
| A.质量数为198 | B.中子数为140 |
| C.质子数为82 | D.核外电子数为58 |